(-)-(2S,4S,9aS)-2-hydroxy-4-(3,4-dimethoxyphenyl)-decahydroquinolizidine | 89771-49-3
中文名称
——
中文别名
——
英文名称
(-)-(2S,4S,9aS)-2-hydroxy-4-(3,4-dimethoxyphenyl)-decahydroquinolizidine
英文别名
(2S,4S,9aS)-4-(3,4-dimethoxyphenyl)octahydro-1H-quinolizine-2-ol;(2S,4S,9aS)-4-(3,4-dimethoxyphenyl)octahydro-2H-quinolizin-2-ol;4-(3,4-dimethoxyphenyl)-octahydroquinolizin-2-ol;(-)-lasubine II;lasubine II;lasubin II;2H-quinolizin-2-ol, 4-(3,4-dimethoxyphenyl)octahydro-, (2S,4S,9aS)-;(2S,4S,9aS)-4-(3,4-dimethoxyphenyl)-2,3,4,6,7,8,9,9a-octahydro-1H-quinolizin-2-ol
CAS
89771-49-3
化学式
C17H25NO3
mdl
——
分子量
291.39
InChiKey
YEFMCXAZLNBVEN-KKUMJFAQSA-N
BEILSTEIN
——
EINECS
——
-
物化性质
-
计算性质
-
ADMET
-
安全信息
-
SDS
-
制备方法与用途
-
上下游信息
-
文献信息
-
表征谱图
-
同类化合物
-
相关功能分类
-
相关结构分类
物化性质
-
沸点:436.3±45.0 °C(Predicted)
-
密度:1.16±0.1 g/cm3(Predicted)
计算性质
-
辛醇/水分配系数(LogP):2.5
-
重原子数:21
-
可旋转键数:3
-
环数:3.0
-
sp3杂化的碳原子比例:0.65
-
拓扑面积:41.9
-
氢给体数:1
-
氢受体数:4
上下游信息
-
上游原料
中文名称 英文名称 CAS号 化学式 分子量 —— (2R,4S,9aS)-2-hydroxy-4-(3,4-dimethoxyphenyl)-decahydroquinolizidine 386285-44-5 C17H25NO3 291.39 —— (2S,4S,6S)-(-)-2-(3,4-dimethoxyphenyl)-6-(4-hydroxybutyl)-piperidin-4-ol 263247-25-2 C17H27NO4 309.406 —— (2S,4S,6S)-2-(3,4-dimethoxyphenyl)-6-[4-(2-methoxyethoxymethoxy)butyl]piperidin-4-ol 263247-23-0 C21H35NO6 397.512 —— (2R,4S,9aS)-2-(tert-butyldimethylsilyloxy)-4-(3,4-dimethoxyphenyl)octahydro-1H-quinolizine 1333213-20-9 C23H39NO3Si 405.653 —— (2S,4S,6S)-(-)-2-(4-benzyloxy-butyl)-6-(3,4-dimethoxy-phenyl)-piperidin-4-ol 299210-05-2 C24H33NO4 399.53 —— (2S,4R,6S)-2-(4-(benzyloxy)butyl)-6-(3,4-dimethoxyphenyl)piperidine-4-ol 1333213-17-4 C24H33NO4 399.53 —— (4S,10S)-4-(3,4-dimethoxyphenyl)-2-methylenequinolizidine 221664-10-4 C18H25NO2 287.402 —— (4S,9aS)-4-(3,4-dimethoxyphenyl)hexahydro-1H-quinolizin-2(6H)-one 221664-11-5 C17H23NO3 289.375 —— 4-((2S,4R,6S)-4-(tert-butyldimethylsilyloxy)-6-(3,4-dimethoxyphenyl)piperidine-2-yl)butane-1-ol 1333213-19-6 C23H41NO4Si 423.668 —— (6S,9aR)-6-(3,4-Dimethoxy-phenyl)-8-methylene-octahydro-quinolizin-4-one 221664-08-0 C18H23NO3 301.386 —— (4S,10R)-4-(3,4-dimethoxyphenyl)-1,3,4,6,7,10-hexahydroquinolizin-2-one 791822-03-2 C17H21NO3 287.359 —— (4R,10R)-4-(3,4-dimethoxyphenyl)-1,3,4,6,7,10-hexahydroquinolizin-2-one 791822-00-9 C17H21NO3 287.359 —— (2S,4R,6S)-2-(4-(benzyloxy)butyl)-6-(3,4-dimethoxyphenyl)-7-oxa-1-azabicyclo[2.2.1]heptane 1333213-16-3 C24H31NO4 397.514 —— benzyl N-[(1S,3R)-1-(3,4-dimethoxyphenyl)-3-hydroxy-9-(2-methoxyethoxymethoxy)-5-oxononyl]carbamate 263247-22-9 C29H41NO9 547.646 —— (2R,4R,6S)-2-(Z)-(4-(benzyloxy)but-1-enyl)-6-(3,4-dimethoxyphenyl)-7-oxa-1-azabicyclo[2.2.1]heptane 1333213-14-1 C24H29NO4 395.499 —— methyl (3S)-3-amino-3-(3,4-dimethoxyphenyl)propanoate 167887-40-3 C12H17NO4 239.271 —— (2S,4S,6R)-2-(3,4-dimethoxyphenyl)-6-((S)-1,4-dioxaspiro[4,5]decane-2-yl)-7-oxa-1-azabicyclo[2.2.1]heptane 1333213-07-2 C21H29NO5 375.465 —— (RS,1S,3R)-(-)-1-N-(p-toluenesulfinyl)amino 1-(3,4-dimethoxyphenyl)-3-hydroxy-5-oxo-9-benzyloxynonane 299210-01-8 C31H39NO6S 553.72 —— (S)-4-(3,4-dimethoxyphenyl)-2-oxo-3,4,6,7,8,9-hexahydro-2H-quinolizine-1-carboxylic acid ethyl ester 386285-40-1 C20H25NO5 359.422 - 1
- 2
-
下游产品
中文名称 英文名称 CAS号 化学式 分子量 十齿草次碱 (±)-decinine 10183-64-9 C26H31NO5 437.536 —— Methyldecinin —— C27H33NO5 451.563
反应信息
-
作为反应物:描述:(-)-(2S,4S,9aS)-2-hydroxy-4-(3,4-dimethoxyphenyl)-decahydroquinolizidine 在 4-二甲氨基吡啶 、 palladium on carbon 、 氢气 、 potassium carbonate 、 盐酸-N-乙基-Nˊ-(3-二甲氨基丙基)碳二亚胺 作用下, 以 二氯甲烷 、 乙酸乙酯 、 丙酮 为溶剂, 反应 30.0h, 生成 2-(p-benzyloxyphenylpropionoyloxy)(a)-4-(3',4'-dimethoxyphenyl)(e)-trans-quinolizidine参考文献:名称:Total Synthesis of (±)-Decinine via an Oxidative Biaryl Coupling with Defined Axial Chirality摘要:The total synthesis of (+/-)-decinine has been achieved. The key steps in the synthesis involved the formation of lasubine II via a gold catalyzed annulation of 1-(but-3-yn-1-yl)piperidine and the formation of the 12-membered ring of decinine (1) with complementary atropselectivity via a VOF3-mediated oxidative biaryl coupling reaction.DOI:10.1021/ol3015573
-
作为产物:描述:pelletierine 在 氢溴酸 、 L-Selectride 、 sodium carbonate 、 溶剂黄146 、 sodium hydroxide 作用下, 以 四氢呋喃 、 乙醇 、 二氯甲烷 、 水 为溶剂, 反应 12.0h, 生成 (-)-(2S,4S,9aS)-2-hydroxy-4-(3,4-dimethoxyphenyl)-decahydroquinolizidine参考文献:名称:Pelletierine不对称构建的策略及其在Sedridine,Myrtine和Lasubine合成中的应用摘要:描述了三种合成旋光性小核黄素的对映体的方法。这些化合物作为结构单元的有用性在几种基于哌啶的目标化合物的不对称合成中得到了证明。DOI:10.1002/ejoc.201900477
文献信息
-
Broad Spectrum Enolate Equivalent for Catalytic Chemo-, Diastereo-, and Enantioselective Addition to <i>N</i>-Boc Imines作者:Barry M. Trost、Chao-I (Joey) HungDOI:10.1021/jacs.5b11248日期:2015.12.23Their susceptibility to other reactions such as Michael additions and the difficulty of controlling the enolate geometry make them difficult substrates. Mannich-type reactions, which previously have not been reported using N-carbamoyl-imines with simple ketone enolates, became our objective. In this report, we describe the first direct catalytic Mannich-type reaction between various ynones and N-Boc炔基酮在烯醇化学中是有吸引力但具有挑战性的亲核试剂。它们对迈克尔加成等其他反应的敏感性以及控制烯醇几何结构的困难使它们成为困难的底物。曼尼希型反应,以前没有报道过使用 N-氨基甲酰基亚胺和简单的酮烯醇化物,成为我们的目标。在本报告中,我们描述了各种炔酮和 N-Boc 亚胺之间的第一个直接催化曼尼希型反应,其立体控制可能来自烯醇几何的催化剂控制。该方法产生具有优异化学选择性、非对映选择性和对映选择性的 α-取代 β-氨基炔酮。通过进一步的一步转化,产品可以很容易地转化为广泛的分子支架,证明了ynones作为各种不对称取代的无环酮的掩蔽合成等价物的效用。特别是,炔基烷基酮解决了长期存在的问题,即无法将缺乏α-支化的不对称二烷基酮的烯醇化物用于区域和立体选择性反应。
-
Preparation of Enantiopure Substituted Piperidines Containing 2-Alkene or 2-Alkyne Chains: Application to Total Syntheses of Natural Quinolizidine-Alkaloids作者:Guolin Cheng、Xinyan Wang、Deyong Su、Hui Liu、Fei Liu、Yuefei HuDOI:10.1021/jo902615u日期:2010.3.19nonracemic Betti base as a chiral auxiliary. The key step is that the auxiliary residue was removed by a novel base-catalyzed N-debenzylation via a formation of o-quinone methide mechanism in stead of the traditional hydrogenolysis, by which the alkene or alkyne groups survived. By this method, ten 2-alkene- or 2-alkyne-containing chain substituted piperidines were prepared on the gram scale within
-
Biomimetic Organocatalytic Approach to 4-Arylquinolizidine Alkaloids and Application in the Synthesis of (−)-Lasubine II and (+)-Subcosine II作者:Seerat Virk、Sunil V. PansareDOI:10.1021/acs.orglett.9b01840日期:2019.7.19An enantioselective, biomimetic organocatalytic synthesis of 4-arylquinolizidin-2-ones, key intermediates in the synthesis of several Lythraceae alkaloids, was developed. The methodology features S-proline-mediated Mannich/aza-Michael reactions of readily available arylideneacetones and Δ1-piperideine. The total syntheses of (−)-lasubine II and (+)-subcosine II as well as the formal syntheses of structurally
-
Concise enantioselective synthesis of (−)-lasubine II作者:Mirko Zaja、Siegfried BlechertDOI:10.1016/j.tet.2004.06.145日期:2004.10An enantioselective synthesis of the quinolizidine alkaloid (−)-lasubine II 1 is reported. Two different pathways to the key intermediate 2 are described. The first case involving a sequence of ring rearrangement metathesis (RRM), simple functional group interconversion operations, followed by a stereoselective cross metathesis (CM) and in the second case a domino ring opening-/ring closing-/cross
-
Enantiodivergent Approach to the Synthesis of <i>Cis</i>-2,6-Disubstituted Piperidin-4-ones作者:Alejandro Lahosa、Miguel Yus、Francisco FoubeloDOI:10.1021/acs.joc.9b01008日期:2019.6.7β-amino ketone derivatives were synthesized by decarboxylative Mannich reaction of chiral N-tert-butanesulfinyl imines with β-keto acids and were subsequently transformed into cis-2,6-disubstituted piperidin-4-ones through an organocatalyzed condensation with aldehydes. Both enantiomers were accessible from the same precursors by inverting the order in the reaction sequence of the aldehydes involved
表征谱图
-
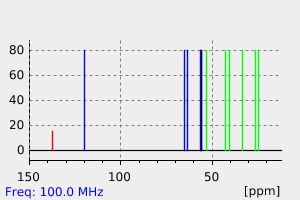
氢谱1HNMR
-
质谱MS
-
碳谱13CNMR
-
红外IR
-
拉曼Raman
-
峰位数据
-
峰位匹配
-
表征信息
同类化合物
(R)-3-甲基哌啶盐酸盐;
(R)-2-苄基哌啶-1-羧酸叔丁酯
((3S,4R)-3-氨基-4-羟基哌啶-1-基)(2-(1-(环丙基甲基)-1H-吲哚-2-基)-7-甲氧基-1-甲基-1H-苯并[d]咪唑-5-基)甲酮盐酸盐
高氯酸哌啶
高托品酮肟
马来酸帕罗西汀
颜料红48:4
顺式3-氟哌啶-4-醇盐酸盐
顺式2,6-二甲基哌啶-4-酮
顺式1-苄基-4-甲基-3-甲氨基-哌啶
顺式-叔丁基4-羟基-3-甲基哌啶-1-羧酸酯
顺式-6-甲基-哌啶-1,3-二甲酸1-叔丁酯
顺式-5-(三氟甲基)哌啶-3-羧酸甲酯盐酸盐
顺式-4-叔丁基-2-甲基哌啶
顺式-4-Boc-氨基哌啶-3-甲酸甲酯
顺式-4-(氮杂环丁烷-1-基)-3-氟哌
顺式-3-顺式-4-氨基哌啶
顺式-3-甲氧基-4-氨基哌啶
顺式-3-BOC-3,7-二氮杂双环[4.2.0]辛烷
顺式-3-(1-吡咯烷基)环丁腈
顺式-3,5-哌啶二羧酸
顺式-3,4-二溴-3-甲基吡咯烷盐酸盐
顺式-2,6-二甲基-4-氧代哌啶-1-羧酸叔丁基酯
顺式-1-叔丁氧羰基-4-甲基氨基-3-羟基哌啶
顺式-1-boc-3,4-二氨基哌啶
顺式-1-(4-叔丁基环己基)-4-苯基-4-哌啶腈
顺式-1,3-二甲基-4-乙炔基-6-苯基-3,4-哌啶二醇
顺-4-(4-氟苯基)-1-(4-异丙基环己基)-4-哌啶羧酸
顺-4-(2-氟苯基)-1-(4-异丙基环己基)-4-哌啶羧酸
顺-3-氨基-4-氟哌啶-1-羧酸叔丁酯
顺-1-苄基-4-甲基哌啶-3-氨基酸甲酯盐酸盐
非莫西汀
雷芬那辛
雷拉地尔
阿维巴坦中间体4
阿格列汀杂质
阿尼利定盐酸盐 CII
阿尼利定
阿塔匹酮
阿哌沙班杂质BMS-591455
阿哌沙班杂质87
阿哌沙班杂质52
阿哌沙班杂质51
阿哌沙班杂质5
阿哌沙班杂质
阿哌沙班杂质
阿哌沙班-d3
阿哌沙班
阻聚剂701
间氨基谷氨酰胺