三甲基苯甲醇 | 1197-01-9
-
物化性质
-
计算性质
-
ADMET
-
安全信息
-
SDS
-
制备方法与用途
-
上下游信息
-
文献信息
-
表征谱图
-
同类化合物
-
相关功能分类
-
相关结构分类
物化性质
-
沸点:64 °C0.6 mm Hg(lit.)
-
密度:0.97 g/mL at 25 °C(lit.)
-
闪点:205 °F
-
溶解度:可溶于氯仿、甲醇(少许)
-
LogP:2.19
-
物理描述:P-cymen-8-ol is a clear colorless to pale yellow liquid with an herbaceous celery-like odor. (NTP, 1992)
-
熔点:9°C
-
蒸汽密度:greater than 1 (Air=1) (NTP, 1992) (Relative to Air)
-
折光率:1.516-1.520
-
保留指数:1172;1158.9;1158.9;1159;1156;1160;1179;1158;1191;1158;1162;1183;1164;1170;1158;1157;1162;1158;1158;1157;1152;1184;1158;1158;1158;1163;1163;1159;1187;1169;1159;1162;1171;1161;1174;1172;1169;1165;1168;1160;1171;1148;1180;1179;1159;1158;1157;1167;1167;1183;1167;1161;1163;1148;1148;1183;1163;1173;1158;1160;1183;1170;1167;1162;1163;1166;1186;1147;1158;1162;1162.3;1168.8;1163;1174;1158;1199;1156;1158;1167;1167;1159;1165;1162;1160;1148;1148;1159;1165;1148;1166;1165;1168;1169;1167
-
稳定性/保质期:
存在于烤烟烟叶和烟气中。
计算性质
-
辛醇/水分配系数(LogP):2
-
重原子数:11
-
可旋转键数:1
-
环数:1.0
-
sp3杂化的碳原子比例:0.4
-
拓扑面积:20.2
-
氢给体数:1
-
氢受体数:1
安全信息
-
WGK Germany:2
-
海关编码:2902909090
-
储存条件:室温
SDS
模块 1. 化学品
1.1 产品标识符
: 三甲基苯甲醇
产品名称
1.2 鉴别的其他方法
无数据资料
1.3 有关的确定了的物质或混合物的用途和建议不适合的用途
仅用于研发。不作为药品、家庭或其它用途。
模块 2. 危险性概述
2.1 GHS-分类
根据全球协调系统(GHS)的规定,不是危险物质或混合物。
2.3 其它危害物 - 无
模块 3. 成分/组成信息
3.1 物 质
: C10H14O
分子式
: 150.22 g/mol
分子量
无
模块 4. 急救措施
4.1 必要的急救措施描述
吸入
如果吸入,请将患者移到新鲜空气处。 如呼吸停止,进行人工呼吸。
皮肤接触
用肥皂和大量的水冲洗。
眼睛接触
用水冲洗眼睛作为预防措施。
食入
切勿给失去知觉者通过口喂任何东西。 用水漱口。
4.2 主要症状和影响,急性和迟发效应
4.3 及时的医疗处理和所需的特殊处理的说明和指示
无数据资料
模块 5. 消防措施
5.1 灭火介质
灭火方法及灭火剂
用水雾,抗乙醇泡沫,干粉或二氧化碳灭火。
5.2 源于此物质或混合物的特别的危害
碳氧化物
5.3 给消防员的建议
如必要的话,戴自给式呼吸器去救火。
5.4 进一步信息
无数据资料
模块 6. 泄露应急处理
6.1 作业人员防护措施、防护装备和应急处置程序
避免吸入蒸气、烟雾或气体。
6.2 环境保护措施
不要让产品进入下水道。
6.3 泄漏化学品的收容、清除方法及所使用的处置材料
放入合适的封闭的容器中待处理。
6.4 参考其他部分
丢弃处理请参阅第13节。
模块 7. 操作处置与储存
7.1 安全操作的注意事项
一般性的防火保护措施。
7.2 安全储存的条件,包括任何不兼容性
贮存在阴凉处。 使容器保持密闭,储存在干燥通风处。
打开了的容器必须仔细重新封口并保持竖放位置以防止泄漏。
7.3 特定用途
无数据资料
模块 8. 接触控制和个体防护
8.1 容许浓度
最高容许浓度
没有已知的国家规定的暴露极限。
8.2 暴露控制
适当的技术控制
常规的工业卫生操作。
个体防护设备
眼/面保护
请使用经官方标准如NIOSH (美国) 或 EN 166(欧盟) 检测与批准的设备防护眼部。
皮肤保护
戴手套取 手套在使用前必须受检查。
请使用合适的方法脱除手套(不要接触手套外部表面),避免任何皮肤部位接触此产品.
使用后请将被污染过的手套根据相关法律法规和有效的实验室规章程序谨慎处理. 请清洗并吹干双手
所选择的保护手套必须符合EU的89/686/EEC规定和从它衍生出来的EN 376标准。
身体保护
防渗透的衣服, 防护设备的类型必须根据特定工作场所中的危险物的浓度和数量来选择。
呼吸系统防护
不需要对呼吸系统保护.对少量挥发请采用美国OV/AG (US)标准类型的 或欧洲ABEK (EU EN
14387)标准类型的呼吸器过滤器.
呼吸器使用经过测试并通过政府标准如NIOSH(US)或CEN(EU)的呼吸器和零件。
模块 9. 理化特性
9.1 基本的理化特性的信息
a) 外观与性状
形状: 液体
b) 气味
无数据资料
c) 气味阈值
无数据资料
d) pH值
无数据资料
e) 熔点/凝固点
无数据资料
f) 沸点、初沸点和沸程
64 °C 在 0.8 hPa - lit.
g) 闪点
96.00 °C - 闭杯
h) 蒸发速率
无数据资料
i) 易燃性(固体,气体)
无数据资料
j) 高的/低的燃烧性或爆炸性限度 无数据资料
k) 蒸气压
无数据资料
l) 蒸汽密度
无数据资料
m) 密度/相对密度
0.97 g/mL 在 25 °C
n) 水溶性
无数据资料
o) n-辛醇/水分配系数
无数据资料
p) 自燃温度
无数据资料
q) 分解温度
无数据资料
r) 粘度
无数据资料
模块 10. 稳定性和反应活性
10.1 反应性
无数据资料
10.2 稳定性
无数据资料
10.3 危险反应
无数据资料
10.4 应避免的条件
无数据资料
10.5 不相容的物质
强氧化剂
10.6 危险的分解产物
其它分解产物 - 无数据资料
模块 11. 毒理学资料
11.1 毒理学影响的信息
急性毒性
无数据资料
皮肤刺激或腐蚀
无数据资料
眼睛刺激或腐蚀
无数据资料
呼吸道或皮肤过敏
无数据资料
生殖细胞致突变性
无数据资料
致癌性
IARC:
此产品中没有大于或等于 0。1%含量的组分被 IARC鉴别为可能的或肯定的人类致癌物。
生殖毒性
无数据资料
特异性靶器官系统毒性(一次接触)
无数据资料
特异性靶器官系统毒性(反复接触)
无数据资料
吸入危险
无数据资料
潜在的健康影响
吸入 吸入可能有害。 可能引起呼吸道刺激。
摄入 如服入是有害的。
皮肤 通过皮肤吸收可能有害。 可能引起皮肤刺激。
眼睛 可能引起眼睛刺激。
附加说明
化学物质毒性作用登记: 无数据资料
模块 12. 生态学资料
12.1 生态毒性
无数据资料
12.2 持久性和降解性
无数据资料
12.3 潜在的生物累积性
无数据资料
12.4 土壤中的迁移性
无数据资料
12.5 PBT 和 vPvB的结果评价
无数据资料
12.6 其它不良影响
无数据资料
模块 13. 废弃处置
13.1 废物处理方法
产品
将剩余的和不可回收的溶液交给有许可证的公司处理。
受污染的容器和包装
按未用产品处置。
模块 14. 运输信息
14.1 联合国危险货物编号
欧洲陆运危规: - 国际海运危规: - 国际空运危规: -
14.2 联合国运输名称
欧洲陆运危规: 非危险货物
国际海运危规: 非危险货物
国际空运危规: 非危险货物
14.3 运输危险类别
欧洲陆运危规: - 国际海运危规: - 国际空运危规: -
14.4 包裹组
欧洲陆运危规: - 国际海运危规: - 国际空运危规: -
14.5 环境危险
欧洲陆运危规: 否 国际海运危规 国际空运危规: 否
海洋污染物(是/否): 否
14.6 对使用者的特别提醒
无数据资料
模块 15 - 法规信息
N/A
模块16 - 其他信息
N/A
制备方法与用途
2-(4-甲基苯基)丙-2-醇可用于制备用于HBV治疗的硫化烷基化合物和吡啶类反式磺酰胺化合物。
应用举例该物质适用于合成具有特定结构的化合物,这些化合物能够通过破坏、加速、降低、延迟或抑制正常HBV病毒复制来达到治疗目的。它们可以诱导异常病毒复制并产生抗病毒效应,比如破坏病毒体装配或拆解、促进病毒体成熟或促进病毒排出。
制备2-(4-甲基苯基)丙-2-醇可通过4-甲基异丙苯氧化得到。
制备过程如下:在25mL反应管中,将0.0011g(0.001mmol)的5,10,15,20-四(2,3,6-三氯苯基)卟啉锰(II)分散于1.3422g(10mmol)的4-甲基异丙苯中,搅拌升温至80℃。然后通入氧气(1.0atm),并在80℃下以800rpm的速度搅拌反应8.0小时。
反应完成后,冷却至室温,并向反应混合物中加入1.3115g(5.00mmol)的三苯基膦(PPh₃),继续在室温下搅拌40分钟以还原生成的过氧化物。使用丙酮作为溶剂,将所得反应混合物定容至50mL,并移取10mL溶液进行气相色谱分析。
分析结果显示:4-甲基异丙苯转化率为20.8%,2-(4-甲基苯基)丙-2-醇的选择性为51%,4-甲基苯乙酮选择性为0%,4-甲基异丙苯氢过氧化物选择性为49%,未检测到苯甲酸的生成。
上下游信息
-
上游原料
中文名称 英文名称 CAS号 化学式 分子量 百里香酚杂质 8-hydroperoxy-p-cymene 3077-71-2 C10H14O2 166.22 4-异丙基甲苯 4-methylisopropylbenzene 99-87-6 C10H14 134.221 -
下游产品
中文名称 英文名称 CAS号 化学式 分子量 —— 2-(4-(hydroxymethyl)phenyl)propan-2-ol 88416-58-4 C10H14O2 166.22 —— 2-(4-(bromomethyl)phenyl)propan-2-ol 350236-74-7 C10H13BrO 229.117 —— α,α-dimethyl-4-methylbenzyl methyl ether 55708-37-7 C11H16O 164.247 百里香酚杂质 8-hydroperoxy-p-cymene 3077-71-2 C10H14O2 166.22 4-异丙基甲苯 4-methylisopropylbenzene 99-87-6 C10H14 134.221 叔丁基1-甲基-1-(4-甲苯基)乙基过氧化物 1,1-dimethylethyl-1-methyl(4-methylphenyl)ethyl peroxide 52031-76-2 C14H22O2 222.327 —— Dicumylperoxid 7664-82-6 C20H26O2 298.425 —— trimethyl(2-(p-tolyl)propan-2-yloxy)silane 1403992-16-4 C13H22OSi 222.403 1-甲基-1-(对甲苯基)乙酸乙酯 1-methyl-1-(p-tolyl)ethyl acetate 5062-38-4 C12H16O2 192.258 异丙苯 Isopropylbenzene 98-82-8 C9H12 120.194 —— (R)-2-p-tolylpropan-1-ol 122091-54-7 C10H14O 150.221 2-(4-甲基苯基)-1-丙醇 para-cymen-9-ol 4371-50-0 C10H14O 150.221 —— (S)-2-(p-tolyl)propan-1-ol 93922-51-1 C10H14O 150.221 - 1
- 2
反应信息
-
作为反应物:描述:参考文献:名称:Boedtker; Kerlor, Comptes Rendus Hebdomadaires des Seances de l'Academie des Sciences, 1929, vol. 188, p. 1682摘要:DOI:
-
作为产物:参考文献:名称:Reduction of hydroperoxides摘要:公开号:US02484841A1
文献信息
-
Kinetics and Mechanism of Acid Catalysed Hydration of α-Methylstyrenes作者:Oldřich Pytela、Bronislav TrlidaDOI:10.1135/cccc20071025日期:——
Twelve
para -substituted α-methylstyrenes with substituents H, CH3, CF3, CH3O, CH3S, F, Cl, Br, CH3CO, CH3SO2, CN a NO2 were synthesised; additionally, the acid catalysed hydration kinetics of these compounds were measured in sulfuric acid in a concentration rangec from 0.017 to 9.58 mol l-1, at 25.0 °C. The observed rate constants obtained were used to construct the kinetic acidity function and calculate the catalytic rate constants. Based on the evaluation of the acidity function kinetic dependence on acid medium concentration, and the substituent effects of acid catalysed hydration of α-methylstyrenes on the catalytic rate constants, the mechanism of acid catalysed hydration was verified. The mechanism involves the addition of a proton to the double bond of α-methylstyrene in the rate-limiting reaction step denoted as A-SE2. No evident difference was found between the effects of the acid medium on the acid catalysed hydration of styrenes and α-methylstyrenes, which indicates very similar activity coefficients of the reactants, and of the transition state of both substrates. The substituent effects evaluation shows that the rate-limiting step of the reaction consists in the addition of a proton to the substrate. The carbocation formation in the transition state of this reaction step proceeds roughly half-way compared with the extent of the carbocation formation by cumyl chloride hydrolysis. The obtained carbocation is in particular stabilised by the substituents with +M effect, while the influence of the substituents with -M andI effects is significantly smaller.十二种带有取代基H、CH3、CF3、CH3O、CH3S、F、Cl、Br、CH3CO、CH3SO2、CN和NO2的α-甲基苯乙烯被合成;此外,在浓度范围从0.017到9.58摩尔/升的硫酸中,测量了这些化合物的酸催化水合动力学。所得到的观察速率常数被用来构建动力学酸度函数并计算催化速率常数。通过评估酸性函数动力学对酸性介质浓度的依赖性,以及α-甲基苯乙烯的酸催化水合反应的取代基效应对催化速率常数的影响,验证了酸催化水合的机理。该机理涉及在速率限制的反应步骤中向α-甲基苯乙烯的双键加入质子,被标记为A-SE2。在酸性介质对苯乙烯和α-甲基苯乙烯的酸催化水合的影响之间没有明显差异,这表明反应物和两种底物的过渡态的活性系数非常相似。取代基效应评估显示,反应的速率限制步骤在向底物加入质子时发生。与叔丁基氯化物水解形成的碳正离子相比,该反应步骤的过渡态中的碳正离子形成大致进行了一半。所得到的碳正离子特别受到具有+M效应的取代基的稳定作用,而具有-M和I效应的取代基的影响则明显较小。 -
Selective reaction of benzyl alcohols with HI gas: Iodination, reduction, and indane ring formations作者:Shoji Matsumoto、Masafumi Naito、Takehisa Oseki、Motohiro Akazome、Yasuhiko OtaniDOI:10.1016/j.tet.2017.11.009日期:2017.12Reactions of benzyl alcohols with HI in solvent-free conditions were examined. Three types of reactions (iodination, reduction, and ring formation) occurred depending on the degree of crowding around the benzyl position and the benzylic stabilization of substrates. Results also showed that the ring formation to give indanes proceeded efficiently when HI was used, and that compounds with electron-rich
-
Pincer Ruthenium Catalyzed Intramolecular Silylation of C(sp2)–H Bonds作者:Zheng Huang、Huaquan Fang、Qiaoxing He、Guixia LiuDOI:10.1055/s-0036-1590982日期:2017.11
Reported herein is a highly efficient intramolecular silylation of aromatic C–H bonds catalyzed by a pincer ruthenium complex, giving benzoxasiloles under relatively mild reaction conditions with broad substrate scope and low catalyst loadings. The silylation product can be further converted into a biaryl product by Pd-catalyzed Hiyama–Denmark cross-coupling reactions.
-
Palladium(II)-Catalyzed Efficient C-3 Functionalization of Indoles with Benzylic and Allylic Alcohols under Co-Catalyst, Acid, Base, Additive and External Ligand-Free Conditions作者:Debjit Das、Sujit RoyDOI:10.1002/adsc.201300048日期:2013.5.3The bis(acetonitrile)palladium(II) chloride complex, PdCl2(MeCN)2, efficiently catalyzes the regioselective alkylation of indoles with various benzylic and allylic alcohols under moisture and air insensitive conditions. Notably the reaction does not require any other co‐catalyst, acid, base, additive, or external ligand.
-
Synthesis of Isochromene and Related Derivatives by Rhodium-Catalyzed Oxidative Coupling of Benzyl and Allyl Alcohols with Alkynes作者:Keisuke Morimoto、Koji Hirano、Tetsuya Satoh、Masahiro MiuraDOI:10.1021/jo201923d日期:2011.11.18The straightforward synthesis of isochromene derivatives and related cyclic ethers is achieved by the rhodium-catalyzed oxidative coupling of α,α-disubstituted benzyl and allyl alcohols with alkynes. The hydroxy groups effectively act as the key function for the regioselective C–H bond cleavage.
表征谱图
-
氢谱1HNMR
-
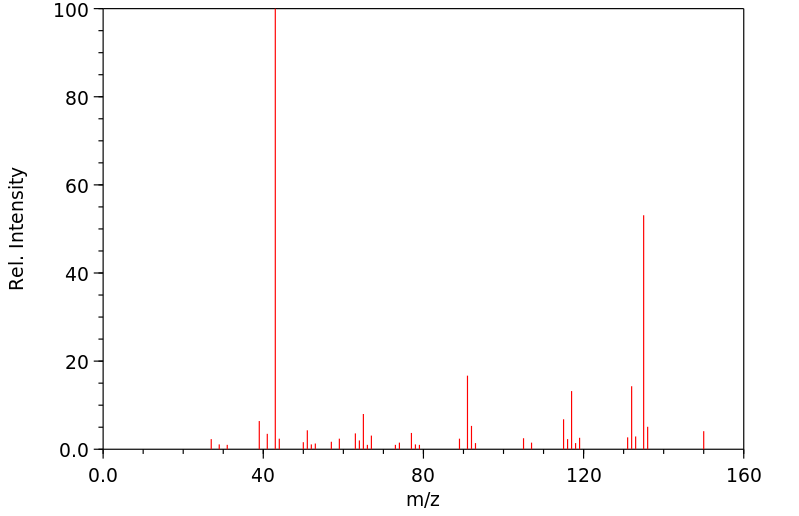
质谱MS
-
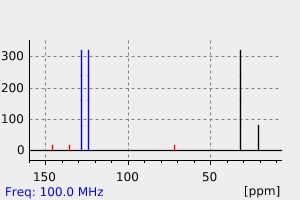
碳谱13CNMR
-
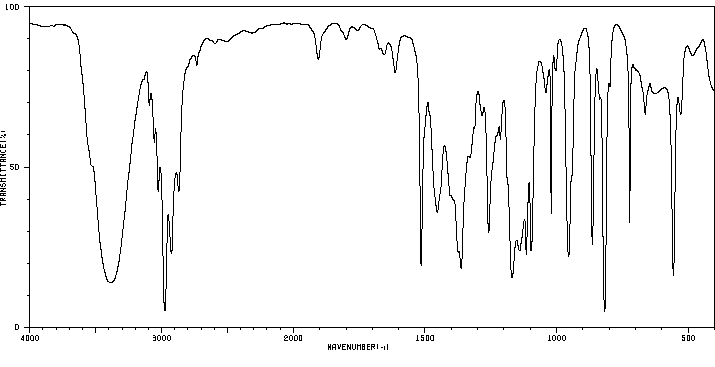
红外IR
-
拉曼Raman
-
峰位数据
-
峰位匹配
-
表征信息