3-甲基苯并[b]噻吩二氧化物 | 6406-91-3
中文名称
3-甲基苯并[b]噻吩二氧化物
中文别名
3-甲基苯并噻吩-1,1-二氧化物
英文名称
3-methyl-1-benzothiophene-1,1-dioxide
英文别名
3-methylbenzo[b]thiophene 1,1-dioxide;3-Methyl-benzothiophen-1,1-dioxid;3-methylbenzothiophene sulfone;3-Methylbenzothiophene 1,1-dioxide;3-methyl-1-benzothiophene 1,1-dioxide
CAS
6406-91-3
化学式
C9H8O2S
mdl
MFCD08695411
分子量
180.227
InChiKey
DCAZNDCIMXHKOS-UHFFFAOYSA-N
BEILSTEIN
——
EINECS
——
-
物化性质
-
计算性质
-
ADMET
-
安全信息
-
SDS
-
制备方法与用途
-
上下游信息
-
文献信息
-
表征谱图
-
同类化合物
-
相关功能分类
-
相关结构分类
计算性质
-
辛醇/水分配系数(LogP):1.2
-
重原子数:12
-
可旋转键数:0
-
环数:2.0
-
sp3杂化的碳原子比例:0.111
-
拓扑面积:42.5
-
氢给体数:0
-
氢受体数:2
安全信息
-
海关编码:2934999090
SDS
上下游信息
-
上游原料
中文名称 英文名称 CAS号 化学式 分子量 —— 3-methylbenzo[b]thiophene S-oxide 51500-43-7 C9H8OS 164.228 1-(2-(甲基磺酰基)苯基)乙酮 1-(2-Methanesulfonyl-phenyl)-ethanone 3323-76-0 C9H10O3S 198.243 -
下游产品
中文名称 英文名称 CAS号 化学式 分子量 —— 6-amino-3-methylbenzo[b]thiophene 1,1-dioxide 67822-95-1 C9H9NO2S 195.242 —— 3-methyl-6-nitro-benzo[b]thiophene 1,1-dioxide 52881-08-0 C9H7NO4S 225.225
反应信息
-
作为反应物:描述:3-甲基苯并[b]噻吩二氧化物 在 bis(norbornadiene)rhodium(l)tetrafluoroborate 、 C46H38F6FeN2P2S 、 氢气 作用下, 以 二氯甲烷 、 2,2,2-三氟乙醇 为溶剂, 70.0 ℃ 、5.07 MPa 条件下, 反应 40.0h, 以97%的产率得到(3R)-3-methyl-2,3-dihydro-1-benzothiophene 1,1-dioxide参考文献:名称:手性2,3-二氢-苯并[高效合成b ]噻吩-1,1-二氧化物通过铑催化的加氢†摘要:成功开发了铑催化的前手性取代苯并[ b ]噻吩1,1-二氧化物的不对称氢化反应,提供了各种手性2,3-二氢苯并[ b]]噻吩1,1-二氧化物,具有高收率和出色的对映选择性(高达99%收率和> 99%ee)。尤其是,对于具有挑战性的底物,例如具有空间位阻基团的芳基取代的底物和烷基取代的底物,反应在我们的催化体系中能顺利进行,并获得优异的结果。在催化剂负载为0.02摩尔%(S / C = 5000)的情况下,克级不对称氢化反应进展顺利,产率为99%,ee为99%。底物和配体之间可能的氢键相互作用可能在实现高反应性和出色的对映选择性中起重要作用。DOI:10.1039/c8sc05397a
-
作为产物:描述:参考文献:名称:Ricci, Annali di Chimica, 1953, vol. 43, p. 323,328摘要:DOI:
文献信息
-
A novel biotransformation of benzofurans and related compounds catalysed by a chloroperoxidase作者:Ricardo G. Alvarez、Iain S. Hunter、Colin J. Suckling、Michael Thomas、Ute VitiniusDOI:10.1016/s0040-4020(01)00837-7日期:2001.10(predominantly trans) formed from the benzofurans were sufficiently stable for isolation and full characterisation. This novel reaction has the potential to be developed into a useful synthetic biotransformation.
-
Enantioselective Hydroarylation or Hydroalkenylation of Benzo[<i>b</i>]thiophene 1,1-Dioxides with Organoboranes作者:Fangdong Hu、Jie Jia、Ximing Li、Ying XiaDOI:10.1021/acs.orglett.0c04114日期:2021.2.5protocol for the asymmetric hydroarylation and hydroalkenylation of benzo[b]thiophene 1,1-dioxides with organoboranes has been developed. The combination of a rhodium(I) precatalyst and a chiral diene ligand constitutes the catalytic system, which enables the facile synthesis of 2,3-dihydrobenzo[b]thiophene 1,1-dioxides in good yields with high enantioselectivities. The merging of this asymmetric hydroarylation已开发出一种有效的方案,用于有机硼烷对苯并[ b ]噻吩1,1-二氧化物的不对称加氢芳基化和加氢烯基化反应。铑(I)预催化剂和手性二烯配体的组合构成了催化体系,该体系能够以高收率和高对映选择性轻松合成2,3-二氢苯并[ b ]噻吩1,1-二氧化物。该不对称氢芳基化与下游烷基化的合并以非对映异构的方式提供了包含两个具有高对映选择性的连续的季立体中心的2,3-二氢苯并[ b ]噻吩1,1-二氧化物。
-
Biomimetic oxidation of organosulfur compounds with hydrogen peroxide catalyzed by manganese porphyrins作者:S.M.G. Pires、M.M.Q. Simões、I.C.M.S. Santos、S.L.H. Rebelo、M.M. Pereira、M.G.P.M.S. Neves、J.A.S. CavaleiroDOI:10.1016/j.apcata.2012.06.044日期:2012.10A biomimetic and environmentally benign approach, with potential application in the oxidative desulfurization procedure for several organosulfur compounds (thioanisol, diphenylsulfide, benzothiophene, 2-methylbenzothiophene, 3-methylbenzothiophene, benzothiophene-2-methanol and dibenzothiophene), is presented. The current methodology involves manganese porphyrins as catalysts, which are well-known
-
噻吩类化合物及其作为USP7抑制剂和抗肿瘤药物的应用
-
一种芳环并噻吩-1,1-二氧化物的制备方法
表征谱图
-
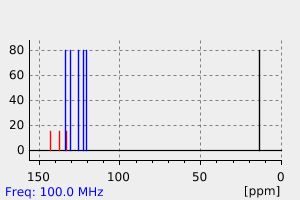
氢谱1HNMR
-
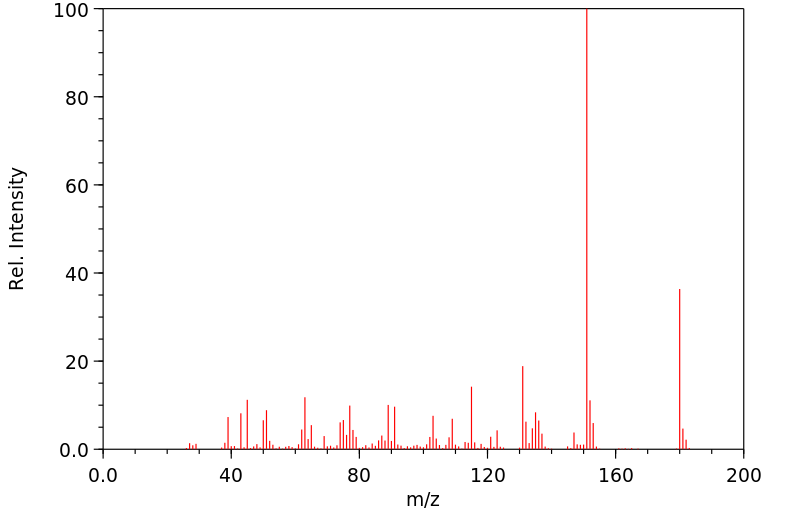
质谱MS
-
碳谱13CNMR
-
红外IR
-
拉曼Raman
-
峰位数据
-
峰位匹配
-
表征信息
同类化合物
(βS)-β-氨基-4-(4-羟基苯氧基)-3,5-二碘苯甲丙醇
(S,S)-邻甲苯基-DIPAMP
(S)-(-)-7'-〔4(S)-(苄基)恶唑-2-基]-7-二(3,5-二-叔丁基苯基)膦基-2,2',3,3'-四氢-1,1-螺二氢茚
(S)-(+)-5,5'',6,6'',7,7'',8,8''-八氢-3,3''-二叔丁基-1,1''-二-2-萘酚,双钾盐
(S)-盐酸沙丁胺醇
(S)-溴烯醇内酯
(S)-7,7-双[(4S)-(苯基)恶唑-2-基)]-2,2,3,3-四氢-1,1-螺双茚满
(S)-3-(叔丁基)-4-(2,6-二甲氧基苯基)-2,3-二氢苯并[d][1,3]氧磷杂环戊二烯
(S)-2-N-Fmoc-氨基甲基吡咯烷盐酸盐
(S)-2,2'-双[双(3,5-三氟甲基苯基)膦基]-4,4',6,6'-四甲氧基联苯
(S)-1-[3,5-双(三氟甲基)苯基]-3-[1-(二甲基氨基)-3-甲基丁烷-2-基]硫脲
(R)富马酸托特罗定
(R)-(-)-盐酸尼古地平
(R)-(-)-4,12-双(二苯基膦基)[2.2]对环芳烷(1,5环辛二烯)铑(I)四氟硼酸盐
(R)-(+)-7-双(3,5-二叔丁基苯基)膦基7''-[((6-甲基吡啶-2-基甲基)氨基]-2,2'',3,3''-四氢-1,1''-螺双茚满
(R)-(+)-7-双(3,5-二叔丁基苯基)膦基7''-[(4-叔丁基吡啶-2-基甲基)氨基]-2,2'',3,3''-四氢-1,1''-螺双茚满
(R)-(+)-7-双(3,5-二叔丁基苯基)膦基7''-[(3-甲基吡啶-2-基甲基)氨基]-2,2'',3,3''-四氢-1,1''-螺双茚满
(R)-(+)-4,7-双(3,5-二-叔丁基苯基)膦基-7“-[(吡啶-2-基甲基)氨基]-2,2”,3,3'-四氢1,1'-螺二茚满
(R)-7,7-双[(4S)-(苯基)恶唑-2-基)]-2,2,3,3-四氢-1,1-螺双茚满
(R)-3-(叔丁基)-4-(2,6-二苯氧基苯基)-2,3-二氢苯并[d][1,3]氧杂磷杂环戊烯
(R)-3-(叔丁基)-4-(2,6-二异丙氧基苯基)-2,3-二氢苯并[d][1,3]氧杂磷杂环戊烯
(R)-3,3''-双([[1,1''-联苯]-4-基)-[1,1''-联萘]-2,2''-二醇
(R)-2-[((二苯基膦基)甲基]吡咯烷
(R)-2,2'',3,3''-四氢-6,6''-二-9-菲基-1,1''-螺双[1H-茚]-7,7''-二醇
(R)-1-[3,5-双(三氟甲基)苯基]-3-[1-(二甲基氨基)-3-甲基丁烷-2-基]硫脲
(N-(4-甲氧基苯基)-N-甲基-3-(1-哌啶基)丙-2-烯酰胺)
(6,6)-苯基-C61己酸甲酯
(5-溴-2-羟基苯基)-4-氯苯甲酮
(5-溴-2-氯苯基)(4-羟基苯基)甲酮
(5-氧代-3-苯基-2,5-二氢-1,2,3,4-oxatriazol-3-鎓)
(4S,5R)-4-甲基-5-苯基-1,2,3-氧代噻唑烷-2,2-二氧化物-3-羧酸叔丁酯
(4S,5R)-3,3a,8,8a-四氢茚并[1,2-d]-1,2,3-氧杂噻唑-2,2-二氧化物-3-羧酸叔丁酯
(4S,4''S)-2,2''-亚环戊基双[4,5-二氢-4-(苯甲基)恶唑]
(4-溴苯基)-[2-氟-4-[6-[甲基(丙-2-烯基)氨基]己氧基]苯基]甲酮
(4-丁氧基苯甲基)三苯基溴化磷
(3aS,8aR)-2-(吡啶-2-基)-8,8a-二氢-3aH-茚并[1,2-d]恶唑
(3aS,3''aS,8aR,8''aR)-2,2''-环戊二烯双[3a,8a-二氢-8H-茚并[1,2-d]恶唑]
(3aR,8aR)-(-)-4,4,8,8-四(3,5-二甲基苯基)四氢-2,2-二甲基-6-苯基-1,3-二氧戊环[4,5-e]二恶唑磷
(3aR,6aS)-5-氧代六氢环戊基[c]吡咯-2(1H)-羧酸酯
(3S,3aR)-2-(3-氯-4-氰基苯基)-3-环戊基-3,3a,4,5-四氢-2H-苯并[g]吲唑-7-羧酸
(3R,3’’R,4S,4’’S,11bS,11’’bS)-(+)-4,4’’-二叔丁基-4,4’’,5,5’’-四氢-3,3’’-联-3H-二萘酚[2,1-c:1’’,2’’-e]膦(S)-BINAPINE
(3-三苯基甲氨基甲基)吡啶
(3-[(E)-1-氰基-2-乙氧基-2-hydroxyethenyl]-1-氧代-1H-茚-2-甲酰胺)
(2′′-甲基氨基-1,1′′-联苯-2-基)甲烷磺酰基铝(II)二聚体
(2Z)-3-[[(4-氯苯基)氨基]-2-氰基丙烯酸乙酯
(2S,4S)-Fmoc-4-三氟甲基吡咯烷-2-羧酸
(2S,3S,5S)-5-(叔丁氧基甲酰氨基)-2-(N-5-噻唑基-甲氧羰基)氨基-1,6-二苯基-3-羟基己烷
(2S,3R)-3-(叔丁基)-2-(二叔丁基膦基)-4-甲氧基-2,3-二氢苯并[d][1,3]氧杂磷杂戊环
(2S,2''S,3S,3''S)-3,3''-二叔丁基-4,4''-双(2,6-二甲氧基苯基)-2,2'',3,3''-四氢-2,2''-联苯并[d][1,3]氧杂磷杂戊环
(2S,2''S,3S,3''S)-3,3''-二叔丁基-4,4''-二甲氧基-2,2'',3,3''-四氢-2,2''-联苯并[d][1,3]氧杂磷杂戊环