丁基琥珀酸酐 | 2035-76-9
中文名称
丁基琥珀酸酐
中文别名
丁琥珀酸酐
英文名称
3-butyldihydrofuran-2,5-dione
英文别名
3-n-butylsuccinic anhydride;n-butylsuccinic anhydride;butylsuccinic anhydride;butylsuccinic acid anhydride;Butyl-bernsteinsaeure-anhydrid;butyl succinic anhydride;3-butyloxolane-2,5-dione
CAS
2035-76-9
化学式
C8H12O3
mdl
MFCD00598109
分子量
156.181
InChiKey
NSJAWXMCLJVBPM-UHFFFAOYSA-N
BEILSTEIN
——
EINECS
——
-
物化性质
-
计算性质
-
ADMET
-
安全信息
-
SDS
-
制备方法与用途
-
上下游信息
-
文献信息
-
表征谱图
-
同类化合物
-
相关功能分类
-
相关结构分类
物化性质
-
熔点:46 °C
-
沸点:269.3±9.0 °C(Predicted)
-
密度:1.089±0.06 g/cm3(Predicted)
-
溶解度:溶于甲苯
-
稳定性/保质期:
如果按照规格使用和储存,则不会分解,没有已知的危险反应。请避免接触氧化物。
计算性质
-
辛醇/水分配系数(LogP):1.6
-
重原子数:11
-
可旋转键数:3
-
环数:1.0
-
sp3杂化的碳原子比例:0.75
-
拓扑面积:43.4
-
氢给体数:0
-
氢受体数:3
安全信息
-
海关编码:2917190090
-
储存条件:请将贮藏器密封,并存放在阴凉、干燥处。同时,确保工作环境具有良好的通风或排气设施。
SDS
丁基琥珀酸酐
模块 1. 化学品
产品名称: Butylsuccinic Anhydride
模块 2. 危险性概述
GHS分类
物理性危害 未分类
健康危害
皮肤腐蚀/刺激 第2级
严重损伤/刺激眼睛 2A类
环境危害 未分类
GHS标签元素
图标或危害标志
信号词 警告
危险描述 造成皮肤刺激
造成严重眼刺激
防范说明
[预防] 处理后要彻底清洗双手。
穿戴防护手套/护目镜/防护面具。
[急救措施] 眼睛接触:用水小心清洗几分钟。如果方便,易操作,摘除隐形眼镜。继续冲洗。
眼睛接触:求医/就诊
皮肤接触:用大量肥皂和水轻轻洗。
若皮肤刺激:求医/就诊。
脱掉被污染的衣物,清洗后方可重新使用。
模块 3. 成分/组成信息
单一物质/混和物 单一物质
化学名(中文名): 丁基琥珀酸酐
百分比: >97.0%(GC)
CAS编码: 2035-76-9
分子式: C8H12O3
丁基琥珀酸酐
模块 4. 急救措施
吸入: 将受害者移到新鲜空气处,保持呼吸通畅,休息。若感不适请求医/就诊。
皮肤接触: 立即去除/脱掉所有被污染的衣物。用大量肥皂和水轻轻洗。
若皮肤刺激或发生皮疹:求医/就诊。
眼睛接触: 用水小心清洗几分钟。如果方便,易操作,摘除隐形眼镜。继续清洗。
如果眼睛刺激:求医/就诊。
食入: 若感不适,求医/就诊。漱口。
紧急救助者的防护: 救援者需要穿戴个人防护用品,比如橡胶手套和气密性护目镜。
模块 5. 消防措施
合适的灭火剂: 干粉,泡沫,雾状水,二氧化碳
特定方法: 从上风处灭火,根据周围环境选择合适的灭火方法。
非相关人员应该撤离至安全地方。
周围一旦着火:如果安全,移去可移动容器。
消防员的特殊防护用具: 灭火时,一定要穿戴个人防护用品。
模块 6. 泄漏应急处理
个人防护措施,防护用具, 使用个人防护用品。远离溢出物/泄露处并处在上风处。
紧急措施: 泄露区应该用安全带等圈起来,控制非相关人员进入。
环保措施: 防止进入下水道。
控制和清洗的方法和材料: 清扫收集粉尘,封入密闭容器。注意切勿分散。附着物或收集物应该立即根据合适的
法律法规处置。
模块 7. 操作处置与储存
处理
技术措施: 在通风良好处进行处理。穿戴合适的防护用具。防止粉尘扩散。处理后彻底清洗双手
和脸。
注意事项: 如果粉尘或浮质产生,使用局部排气。
操作处置注意事项: 避免接触皮肤、眼睛和衣物。
贮存
储存条件: 保持容器密闭。冷藏储存。
存放于惰性气体环境中。
防湿。
远离不相容的材料比如氧化剂存放。
潮敏
包装材料: 依据法律。
模块 8. 接触控制和个体防护
工程控制: 尽可能安装封闭体系或局部排风系统,操作人员切勿直接接触。同时安装淋浴器和洗
眼器。
个人防护用品
呼吸系统防护: 防尘面具。依据当地和政府法规。
手部防护: 防护手套。
眼睛防护: 安全防护镜。如果情况需要,佩戴面具。
皮肤和身体防护: 防护服。如果情况需要,穿戴防护靴。
模块 9. 理化特性
固体
外形(20°C):
外观: 晶体-粉末
丁基琥珀酸酐
模块 9. 理化特性
颜色: 白色-极淡的黄色
气味: 无资料
pH: 无数据资料
熔点:
46°C
沸点/沸程 无资料
闪点: 无资料
爆炸特性
爆炸下限: 无资料
爆炸上限: 无资料
密度: 无资料
溶解度:
[水] 无资料
[其他溶剂]
溶于: 甲苯
模块 10. 稳定性和反应性
化学稳定性: 一般情况下稳定。
危险反应的可能性: 未报道特殊反应性。
须避免接触的物质 氧化剂
危险的分解产物: 一氧化碳, 二氧化碳
模块 11. 毒理学信息
急性毒性: 无资料
对皮肤腐蚀或刺激: 无资料
对眼睛严重损害或刺激: 无资料
生殖细胞变异原性: 无资料
致癌性:
IARC = 无资料
NTP = 无资料
生殖毒性: 无资料
模块 12. 生态学信息
生态毒性:
鱼类: 无资料
甲壳类: 无资料
藻类: 无资料
残留性 / 降解性: 无资料
潜在生物累积 (BCF): 无资料
土壤中移动性
log水分配系数: 无资料
土壤吸收系数 (Koc): 无资料
亨利定律 无资料
constaNT(PaM3/mol):
模块 13. 废弃处置
如果可能,回收处理。请咨询当地管理部门。建议在可燃溶剂中溶解混合,在装有后燃和洗涤装置的化学焚烧炉中
焚烧。废弃处置时请遵守国家、地区和当地的所有法规。
丁基琥珀酸酐
模块 14. 运输信息
联合国分类: 与联合国分类标准不一致
UN编号: 未列明
模块 15. 法规信息
《危险化学品安全管理条例》(2002年1月26日国务院发布,2011年2月16日修订): 针对危险化学品的安全使用、
生产、储存、运输、装卸等方面均作了相应的规定。
模块16 - 其他信息
N/A
模块 1. 化学品
产品名称: Butylsuccinic Anhydride
模块 2. 危险性概述
GHS分类
物理性危害 未分类
健康危害
皮肤腐蚀/刺激 第2级
严重损伤/刺激眼睛 2A类
环境危害 未分类
GHS标签元素
图标或危害标志
信号词 警告
危险描述 造成皮肤刺激
造成严重眼刺激
防范说明
[预防] 处理后要彻底清洗双手。
穿戴防护手套/护目镜/防护面具。
[急救措施] 眼睛接触:用水小心清洗几分钟。如果方便,易操作,摘除隐形眼镜。继续冲洗。
眼睛接触:求医/就诊
皮肤接触:用大量肥皂和水轻轻洗。
若皮肤刺激:求医/就诊。
脱掉被污染的衣物,清洗后方可重新使用。
模块 3. 成分/组成信息
单一物质/混和物 单一物质
化学名(中文名): 丁基琥珀酸酐
百分比: >97.0%(GC)
CAS编码: 2035-76-9
分子式: C8H12O3
丁基琥珀酸酐
模块 4. 急救措施
吸入: 将受害者移到新鲜空气处,保持呼吸通畅,休息。若感不适请求医/就诊。
皮肤接触: 立即去除/脱掉所有被污染的衣物。用大量肥皂和水轻轻洗。
若皮肤刺激或发生皮疹:求医/就诊。
眼睛接触: 用水小心清洗几分钟。如果方便,易操作,摘除隐形眼镜。继续清洗。
如果眼睛刺激:求医/就诊。
食入: 若感不适,求医/就诊。漱口。
紧急救助者的防护: 救援者需要穿戴个人防护用品,比如橡胶手套和气密性护目镜。
模块 5. 消防措施
合适的灭火剂: 干粉,泡沫,雾状水,二氧化碳
特定方法: 从上风处灭火,根据周围环境选择合适的灭火方法。
非相关人员应该撤离至安全地方。
周围一旦着火:如果安全,移去可移动容器。
消防员的特殊防护用具: 灭火时,一定要穿戴个人防护用品。
模块 6. 泄漏应急处理
个人防护措施,防护用具, 使用个人防护用品。远离溢出物/泄露处并处在上风处。
紧急措施: 泄露区应该用安全带等圈起来,控制非相关人员进入。
环保措施: 防止进入下水道。
控制和清洗的方法和材料: 清扫收集粉尘,封入密闭容器。注意切勿分散。附着物或收集物应该立即根据合适的
法律法规处置。
模块 7. 操作处置与储存
处理
技术措施: 在通风良好处进行处理。穿戴合适的防护用具。防止粉尘扩散。处理后彻底清洗双手
和脸。
注意事项: 如果粉尘或浮质产生,使用局部排气。
操作处置注意事项: 避免接触皮肤、眼睛和衣物。
贮存
储存条件: 保持容器密闭。冷藏储存。
存放于惰性气体环境中。
防湿。
远离不相容的材料比如氧化剂存放。
潮敏
包装材料: 依据法律。
模块 8. 接触控制和个体防护
工程控制: 尽可能安装封闭体系或局部排风系统,操作人员切勿直接接触。同时安装淋浴器和洗
眼器。
个人防护用品
呼吸系统防护: 防尘面具。依据当地和政府法规。
手部防护: 防护手套。
眼睛防护: 安全防护镜。如果情况需要,佩戴面具。
皮肤和身体防护: 防护服。如果情况需要,穿戴防护靴。
模块 9. 理化特性
固体
外形(20°C):
外观: 晶体-粉末
丁基琥珀酸酐
模块 9. 理化特性
颜色: 白色-极淡的黄色
气味: 无资料
pH: 无数据资料
熔点:
46°C
沸点/沸程 无资料
闪点: 无资料
爆炸特性
爆炸下限: 无资料
爆炸上限: 无资料
密度: 无资料
溶解度:
[水] 无资料
[其他溶剂]
溶于: 甲苯
模块 10. 稳定性和反应性
化学稳定性: 一般情况下稳定。
危险反应的可能性: 未报道特殊反应性。
须避免接触的物质 氧化剂
危险的分解产物: 一氧化碳, 二氧化碳
模块 11. 毒理学信息
急性毒性: 无资料
对皮肤腐蚀或刺激: 无资料
对眼睛严重损害或刺激: 无资料
生殖细胞变异原性: 无资料
致癌性:
IARC = 无资料
NTP = 无资料
生殖毒性: 无资料
模块 12. 生态学信息
生态毒性:
鱼类: 无资料
甲壳类: 无资料
藻类: 无资料
残留性 / 降解性: 无资料
潜在生物累积 (BCF): 无资料
土壤中移动性
log水分配系数: 无资料
土壤吸收系数 (Koc): 无资料
亨利定律 无资料
constaNT(PaM3/mol):
模块 13. 废弃处置
如果可能,回收处理。请咨询当地管理部门。建议在可燃溶剂中溶解混合,在装有后燃和洗涤装置的化学焚烧炉中
焚烧。废弃处置时请遵守国家、地区和当地的所有法规。
丁基琥珀酸酐
模块 14. 运输信息
联合国分类: 与联合国分类标准不一致
UN编号: 未列明
模块 15. 法规信息
《危险化学品安全管理条例》(2002年1月26日国务院发布,2011年2月16日修订): 针对危险化学品的安全使用、
生产、储存、运输、装卸等方面均作了相应的规定。
模块16 - 其他信息
N/A
上下游信息
-
上游原料
中文名称 英文名称 CAS号 化学式 分子量 2-丁基琥珀酸 n-butylsuccinic acid 1457-39-2 C8H14O4 174.197
反应信息
-
作为反应物:参考文献:名称:有关抗生素肌动蛋白的研究。第四部分 混合酸酐法合成肌动蛋白的结构类似物摘要:烷基琥珀酸酐(III)和O-苄基羟胺之间的反应产生酸(VI)。这些酸(VI)可以通过混合酸酐法与氨基酰胺(II)偶联,得到外消旋物(VIII)和(IX)的混合物。O-苄基异羟肟酸(VIII)和(IX)的氢解产生天然抗生素肌动蛋白(I)的结构类似物[(X)和(XI)] 。DOI:10.1039/p19750000842
-
作为产物:参考文献:名称:Synthesis of Monosubstituted Succinic Acids from tert-Butylsuccinate摘要:我们报道了叔丁基琥珀酸二负离子的制备及其烷基化反应。这种烷基化反应已被证明是制备单取代琥珀酸及其酸酐的有用方法。DOI:10.1055/s-2000-7110
文献信息
-
Synthesis of Cyclic Anhydrides via Ligand‐Enabled C–H Carbonylation of Simple Aliphatic Acids作者:Zhe Zhuang、Alastair N. Herron、Jin‐Quan YuDOI:10.1002/anie.202104645日期:2021.7.19have lent themselves to the one-step preparation of a number of valuable synthetic motifs that are often difficult to prepare through conventional methods. Herein, we report a β- or γ-C(sp3)–H carbonylation of free carboxylic acids using Mo(CO)6 as a convenient solid CO source and enabled by a bidentate ligand, leading to convenient syntheses of cyclic anhydrides. Among these, the succinic anhydride游离羧酸的 C(sp 3 )-H 官能化的发展提供了广泛的通用 C-C 和 C-Y(Y=杂原子)键形成反应。此外,C-H 官能化有助于一步制备许多有价值的合成基序,这些基序通常难以通过常规方法制备。在此,我们报道了使用 Mo(CO) 6对游离羧酸进行β- 或 γ-C(sp 3 )-H 羰基化作为一种方便的固体 CO 源并通过双齿配体实现,从而方便地合成环状酸酐。其中,琥珀酸酐产品是多用途的垫脚石,可通过脱羧官能化在母酸的 β 位单选择性引入各种官能团,从而提供了一种不同的策略来合成先前 β- 无法获得的大量羧酸。 C-H 活化反应。使用手性二齿硫醚配体还可以实现游离环丙烷羧酸的对映选择性羰基化
-
Structure activity studies of ring E analogues of methyllycaconitine. Part 2: Synthesis of antagonists to the α3β4* nicotinic acetylcholine receptors through modifications to the ester作者:Stephen C Bergmeier、Khadiga A Ismail、Kristjan M Arason、Susan McKay、Darrell L Bryant、Dennis B McKayDOI:10.1016/j.bmcl.2004.05.001日期:2004.7number of simpler analogues of the norditerpeniod alkaloid methyllycaconitine (MLA) in an effort to understand molecular determinants of nAChR*small molecule interactions. We have previously reported the synthesis and evaluation of a series of ring E analogues of MLA. We report here the optimization of the alpha3beta4* functional activity of this series of compounds through modification of the ester.
-
A new regioselective synthesis of 3-substituted furan-2(5H)-ones by palladium-catalysed reductive carbonylation of alk-1-ynes作者:Bartolo Gabriele、Giuseppe Salerno、Mirco Costa、Gian Paolo ChiusoliDOI:10.1016/s0040-4039(98)02464-2日期:1999.1or 3-aryl-substituted furan-2(5H)-ones are obtained directly in fair yields by reductive carbonylation of alk-1-ynes in the presence of catalytic amounts of palladium iodide in conjunction with potassium iodide (10 eq.) and water (200 eq.). Simultaneous oxidation of CO to CO2 accounts for the stoichiometry of the process. Reactions are carried out in dioxane under mild conditions (80 °C and 10 atm of
-
Chemical Probing of the Human Sirtuin 5 Active Site Reveals Its Substrate Acyl Specificity and Peptide-Based Inhibitors作者:Claudia Roessler、Theresa Nowak、Martin Pannek、Melanie Gertz、Giang T. T. Nguyen、Michael Scharfe、Ilona Born、Wolfgang Sippl、Clemens Steegborn、Mike SchutkowskiDOI:10.1002/anie.201402679日期:2014.9.26sirtuin 5 is a weak deacetylase but a very efficient demalonylase and desuccinylase; however, its substrate acyl specificity has not been systematically analyzed. Herein, we investigated a carbamoyl phosphate synthetase 1 derived peptide substrate and modified the lysine side chain systematically to determine the acyl specificity of Sirt5. From that point we designed six potent peptide‐based inhibitorsSirtuins是NAD +依赖性脱乙酰基酶,在代谢途径和应激反应中起着传感器的作用。在哺乳动物中,有七个亚型。线粒体sirtuin 5是弱的脱乙酰基酶,但非常有效的脱丙二酰酶和脱琥珀酰酶。然而,尚未对其底物酰基特异性进行系统分析。在本文中,我们研究了氨基甲酰磷酸合成酶1衍生的肽底物,并系统修饰了赖氨酸侧链,以确定Sirt5的酰基特异性。从那时起,我们设计了六种与NAD +相互作用的有效的基于肽的抑制剂装订袋。为了表征导致不同底物和抑制特性的相互作用细节,我们报道了与这些肽复合的Sirt5的几种X射线晶体结构。我们的结果揭示了Sirt5的酰基选择性及其分子基础,并使设计Sirt5的抑制剂成为可能。
-
[EN] SUBSTITUTED THIAZOLE COMPOUNDS<br/>[FR] COMPOSÉS DE THIAZOLE SUBSTITUÉS申请人:HOFFMANN LA ROCHE公开号:WO2014086701A1公开(公告)日:2014-06-12The invention is concerned with the compounds of formula (I) and pharmaceutically acceptable salts thereof. In addition, the present invention relates to methods of manufacturing and using the compounds of formula (I) as well as pharmaceutical compositions containing such compounds. The compounds of formula (I) are LMP7 inhibitors and may be useful in treating associated inflammatory diseases and disorders such as, for example, rheumatoid arthritis, lupus and irritable bowel disease.该发明涉及式(I)的化合物及其药用可接受的盐。此外,本发明涉及制造和使用式(I)化合物的方法,以及含有这些化合物的药物组合物。式(I)的化合物是LMP7抑制剂,可能在治疗相关的炎症性疾病和紊乱方面有用,例如类风湿关节炎、红斑狼疮和肠易激综合征。
表征谱图
-
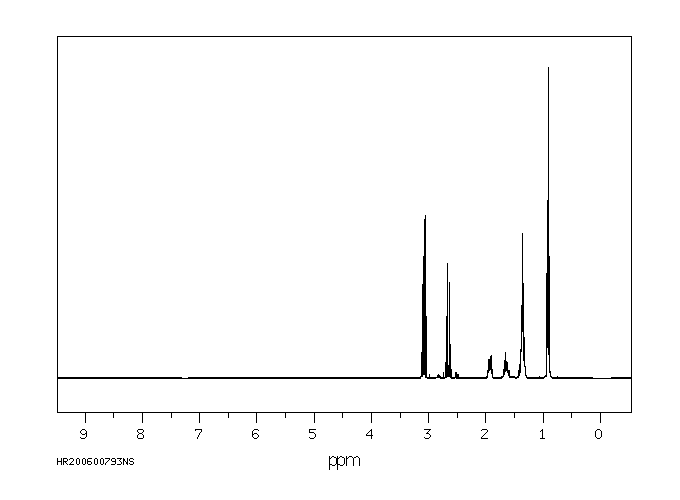
氢谱1HNMR
-
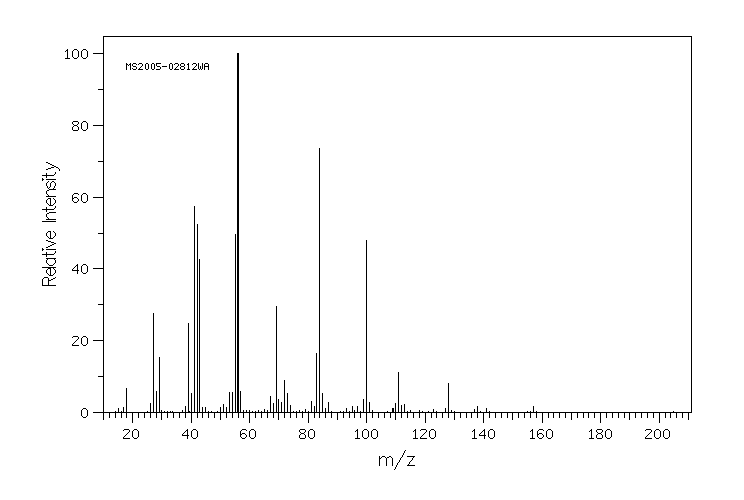
质谱MS
-
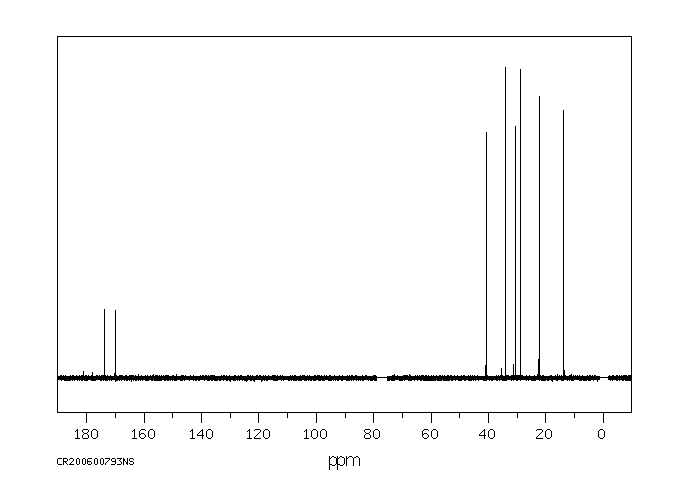
碳谱13CNMR
-
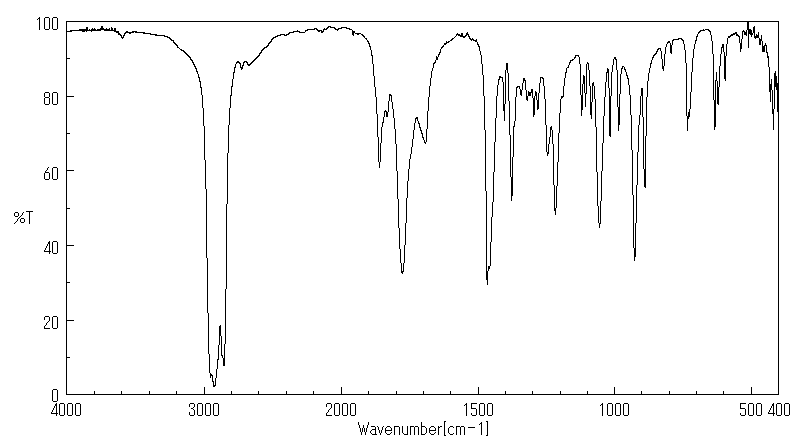
红外IR
-
拉曼Raman
-
峰位数据
-
峰位匹配
-
表征信息
同类化合物
(甲基3-(二甲基氨基)-2-苯基-2H-azirene-2-羧酸乙酯)
(±)-盐酸氯吡格雷
(±)-丙酰肉碱氯化物
(d(CH2)51,Tyr(Me)2,Arg8)-血管加压素
(S)-(+)-α-氨基-4-羧基-2-甲基苯乙酸
(S)-阿拉考特盐酸盐
(S)-赖诺普利-d5钠
(S)-2-氨基-5-氧代己酸,氢溴酸盐
(S)-2-[[[(1R,2R)-2-[[[3,5-双(叔丁基)-2-羟基苯基]亚甲基]氨基]环己基]硫脲基]-N-苄基-N,3,3-三甲基丁酰胺
(S)-2-[3-[(1R,2R)-2-(二丙基氨基)环己基]硫脲基]-N-异丙基-3,3-二甲基丁酰胺
(S)-1-(4-氨基氧基乙酰胺基苄基)乙二胺四乙酸
(S)-1-[N-[3-苯基-1-[(苯基甲氧基)羰基]丙基]-L-丙氨酰基]-L-脯氨酸
(R)-乙基N-甲酰基-N-(1-苯乙基)甘氨酸
(R)-丙酰肉碱-d3氯化物
(R)-4-N-Cbz-哌嗪-2-甲酸甲酯
(R)-3-氨基-2-苄基丙酸盐酸盐
(R)-1-(3-溴-2-甲基-1-氧丙基)-L-脯氨酸
(N-[(苄氧基)羰基]丙氨酰-N〜5〜-(diaminomethylidene)鸟氨酸)
(6-氯-2-吲哚基甲基)乙酰氨基丙二酸二乙酯
(4R)-N-亚硝基噻唑烷-4-羧酸
(3R)-1-噻-4-氮杂螺[4.4]壬烷-3-羧酸
(3-硝基-1H-1,2,4-三唑-1-基)乙酸乙酯
(2S,4R)-Boc-4-环己基-吡咯烷-2-羧酸
(2S,3S,5S)-2-氨基-3-羟基-1,6-二苯己烷-5-N-氨基甲酰基-L-缬氨酸
(2S,3S)-3-((S)-1-((1-(4-氟苯基)-1H-1,2,3-三唑-4-基)-甲基氨基)-1-氧-3-(噻唑-4-基)丙-2-基氨基甲酰基)-环氧乙烷-2-羧酸
(2S)-2,6-二氨基-N-[4-(5-氟-1,3-苯并噻唑-2-基)-2-甲基苯基]己酰胺二盐酸盐
(2S)-2-氨基-N,3,3-三甲基-N-(苯甲基)丁酰胺
(2S)-2-氨基-3-甲基-N-2-吡啶基丁酰胺
(2S)-2-氨基-3,3-二甲基-N-(苯基甲基)丁酰胺,
(2S)-2-氨基-3,3-二甲基-N-2-吡啶基丁酰胺
(2S,4R)-1-((S)-2-氨基-3,3-二甲基丁酰基)-4-羟基-N-(4-(4-甲基噻唑-5-基)苄基)吡咯烷-2-甲酰胺盐酸盐
(2R,3'S)苯那普利叔丁基酯d5
(2R)-2-氨基-3,3-二甲基-N-(苯甲基)丁酰胺
(2-氯丙烯基)草酰氯
(1S,3S,5S)-2-Boc-2-氮杂双环[3.1.0]己烷-3-羧酸
(1R,5R,6R)-5-(1-乙基丙氧基)-7-氧杂双环[4.1.0]庚-3-烯-3-羧酸乙基酯
(1R,4R,5S,6R)-4-氨基-2-氧杂双环[3.1.0]己烷-4,6-二羧酸
齐特巴坦
齐德巴坦钠盐
齐墩果-12-烯-28-酸,2,3-二羟基-,苯基甲基酯,(2a,3a)-
齐墩果-12-烯-28-酸,2,3-二羟基-,羧基甲基酯,(2a,3b)-(9CI)
黄酮-8-乙酸二甲氨基乙基酯
黄荧菌素
黄体生成激素释放激素(1-6)
黄体生成激素释放激素 (1-5) 酰肼
黄体瑞林
麦醇溶蛋白
麦角硫因
麦芽聚糖六乙酸酯
麦根酸