2-乙酰基-5-硝基苯并[b]呋喃 | 23136-39-2
中文名称
2-乙酰基-5-硝基苯并[b]呋喃
中文别名
2-乙酰基-5-硝基苯并[B]呋喃;2-乙酰-5-硝基苯并[B]呋喃
英文名称
2-acetyl-5-nitrobenzofuran
英文别名
1-(5-nitro-benzofuran-2-yl)ethanone;1-(5-nitrobenzofuran-2-yl)ethanone;2-Acetyl-5-nitrobenzofuran;1-(5-nitro-benzofuran-2-yl)-ethanone;1-(5-nitro-1-benzofuran-2-yl)ethanone;5-Nitro-2-acetyl-benzofuran;2-Acetyl-5-nitrobenzo[b]furan
CAS
23136-39-2
化学式
C10H7NO4
mdl
MFCD00051634
分子量
205.17
InChiKey
RMXFQPLULZFJMH-UHFFFAOYSA-N
BEILSTEIN
——
EINECS
——
-
物化性质
-
计算性质
-
ADMET
-
安全信息
-
SDS
-
制备方法与用途
-
上下游信息
-
文献信息
-
表征谱图
-
同类化合物
-
相关功能分类
-
相关结构分类
物化性质
-
熔点:175 °C
-
沸点:350.1±22.0 °C(Predicted)
-
密度:1.370±0.06 g/cm3(Predicted)
-
稳定性/保质期:
如果按照规格使用和储存,则不会分解。请避免接触氧化物。
计算性质
-
辛醇/水分配系数(LogP):2.2
-
重原子数:15
-
可旋转键数:1
-
环数:2.0
-
sp3杂化的碳原子比例:0.1
-
拓扑面积:76
-
氢给体数:0
-
氢受体数:4
安全信息
-
安全说明:S22,S24/25
-
海关编码:2932999099
-
储存条件:保持贮藏器密封,并将其放入一个紧密封装的容器中。储存时请放置在阴凉、干燥处。
SDS
上下游信息
-
上游原料
中文名称 英文名称 CAS号 化学式 分子量 2-乙酰基苯并呋喃 1-(benzo[b]furan-2-yl)ethanone 1646-26-0 C10H8O2 160.172 -
下游产品
中文名称 英文名称 CAS号 化学式 分子量 —— 1-(5-nitro-benzofuran-2-yl)-2-hydroxyethanone 503454-75-9 C10H7NO5 221.169 —— 2-bromo-1-(5-nitro-1-benzofuran-2-yl)ethanone 39904-94-4 C10H6BrNO4 284.066 —— 2-ethyl-5-nitrobenzofuran 29751-78-8 C10H9NO3 191.186 —— 1-(5-amino-benzofuran-2-yl)-ethanone 27408-34-0 C10H9NO2 175.187 —— 1-(5-nitrobenzofuran-2-yl)ethanol 36739-84-1 C10H9NO4 207.186 —— (R)-1-(5-nitrobenzofuran-2-yl)ethanol —— C10H9NO4 207.186 —— (S)-1-(5-nitrobenzofuran-2-yl)ethanol —— C10H9NO4 207.186 —— 2-tosyloxy-1-(5-nitrobenzofuran-2-yl)ethanone 1206485-67-7 C17H13NO7S 375.359
反应信息
-
作为反应物:描述:2-乙酰基-5-硝基苯并[b]呋喃 在 铁粉 、 氯化铵 作用下, 以 乙醇 、 水 为溶剂, 反应 1.0h, 以54%的产率得到1-(5-amino-benzofuran-2-yl)-ethanone参考文献:名称:WO2006/73363摘要:公开号:
-
作为产物:描述:[2-[[chloro(triphenyl)-λ5-phosphanyl]methyl]-4-nitrophenyl] 2-oxopropanoate 以68%的产率得到参考文献:名称:CAPUANO, L.;AHLHELM, A.;HARTMANN, H., CHEM. BER., 1986, 119, N 6, 2069-2074摘要:DOI:
文献信息
-
Synthesis and bioactivity of novel C2-glycosyl benzofuranylthiazoles derivatives as acetylcholinesterase inhibitors作者:Lei Wang、Yu-Ran Wu、Shu-Ting Ren、Long Yin、You-Xian Wang、Shu-Hao Liu、Wei-Wei Liu、Da-Hua Shi、Zhi-Ling Cao、Hui-Min SunDOI:10.1177/1747519819856973日期:2019.7A new series of C2-glycosyl benzofuranylthiazole derivatives was synthesised by the further cyclization of glycosyl thiourea and 2-(bromoacetyl)-benzofuran via Hantzsch’s method. The corresponding 2-(bromoacetyl)-benzofuran derivatives were obtained by the reaction from various salicylaldehydes, and the glycosyl thiourea was prepared through a series of steps from D-Glucosamine. The acetylcholinesterase-inhibitory
-
Design, synthesis and biological evaluation of benzofuran appended benzothiazepine derivatives as inhibitors of butyrylcholinesterase and antimicrobial agents作者:Manizheh Mostofi、Ghodsi Mohammadi Ziarani、Negar LashgariDOI:10.1016/j.bmc.2018.02.049日期:2018.7A series of bezofuran appended 1,5-benzothiazepine compounds 7a–v was designed, synthesized and evaluated as cholinesterase inhibitors. The biological assay experiments showed that most of the compounds displayed a clearly selective inhibition for butyrylcholinesterase (BChE), while a weak or no effect towards acetylcholinesterase (AChE) was detected. All analogs exhibited varied BChE inhibitory activity一系列bezofuran的所附1,5-苯并硫氮杂化合物7A-V被设计,合成和评价为胆碱酯酶抑制剂。生物学测定实验表明,大多数化合物对丁酰胆碱酯酶(BChE)表现出明显的选择性抑制作用,而对乙酰胆碱酯酶(AChE)的作用却微弱或没有。与标准多奈哌齐相比,所有类似物均表现出不同的BChE抑制活性,IC 50值在1.0±0.01至72±2.8μM之间(IC 50为2.63±0.28μM)。在合成衍生物中,化合物7l,7m和7k对IC 50的BChE抑制作用最高分别为1.0、1.0和1.8μM。Lineweaver-Burk图的结果表明化合物7l与BChE的混合型抑制作用。此外,对接研究证实了通过体外实验获得的结果,并表明大多数有效化合物均与BChE活性位点的催化阴离子位点(CAS)和外围阴离子位点(PAS)结合。还评估了合成的化合物的体外抗菌和抗真菌活性。结果表明该化合物对被测微生物具有广谱的活
-
TBAI/TBHP mediated oxidative cross coupling of ketones with phenols and carboxylic acids: Direct access to benzofurans作者:P. Santhosh Kumar、B. Ravikumar、K. Chinna Ashalu、K. Rajender ReddyDOI:10.1016/j.tetlet.2017.11.043日期:2018.1TBAI/TBHP mediated oxidative cross coupling of phenols and carboxylic acids with ketones has been reported under metal-free, base free, solvent free conditions enabling environmentally benign synthesis of aryloxyketones, acyloxy ketones and benzofurans. Phenoxyketones and acyloxylcarbonyl compounds were synthesized in good to high yields, where as benzofurans were synthesized in moderate yields. This
-
Antibacterial activity and polarographic half-wave reduction potential of 2-nitrobenzo(b)furans.作者:YOSHITAKA OHISHI、KIYOSHI KURIYAMA、YOSHIO DOI、TERUO NAKANISHIDOI:10.1248/cpb.33.2854日期:——The antibacterial activities of a series of 2-nitrobenzo [b] furan derivatives against St. aureus, B. subtilis, E. coli, Sal. typhimurium, Sal. enteritidis, Sh. flexneri, Pr. vulgaris or Ps. aeruginosa were determined in vitro. Most of the compounds showed considerable activities against the bacteria except Pr. vulgaris and Ps. aeruginosa and one of them was about 30 times as active as nitrofurantoin against St. aureus. Mono- and dimethoxy derivatives (2a, 3a, 4a, 5f) were the most active. The polarographic half-wave potentials (E1/2) of the 2-nitrobenzo [b] furans at pH 7 were in a narrow range of -0.450±0.04 V, whereas the E1/2 values of regioisomeric nitrobenzo [b] furans were more negative (-0.560--0.726 V). In the case of 2-nitrobenzo [b] furans, substituent (s) on the benzene ring had little influence on the reduction potential of the 2-nitro group, whereas the antibacterial activity depended markedly on the substituent group (s).一系列2-硝基苯并[b]呋喃衍生物对金黄色葡萄球菌、枯草芽孢杆菌、大肠杆菌、鼠伤寒沙门氏菌、肠炎沙门氏菌、弗氏志贺菌、普通变形杆菌或铜绿假单胞菌的抗菌活性在体外被测定。大多数化合物对这些细菌显示出显著的活性,除了普通变形杆菌和铜绿假单胞菌,它们中的一种对金黄色葡萄球菌的活性大约是呋喃西林的30倍。单甲氧基和二甲氧基衍生物(2a, 3a, 4a, 5f)最为活跃。在pH 7时,2-硝基苯并[b]呋喃的极谱半波电位(E1/2)在一个狭窄的范围内,为-0.450±0.04 V,而区域异构的硝基苯并[b]呋喃的E1/2值更为负(-0.560至-0.726 V)。对于2-硝基苯并[b]呋喃来说,苯环上的取代基对2-硝基基团的还原电位几乎没有影响,然而抗菌活性明显取决于取代基团。
-
Chemo-enzymatic preparation of hydroxymethyl ketones作者:Csaba Paizs、Monica Toşa、Cornelia Majdik、Viktória Bódai、Lajos Novák、Florin-Dan Irimie、László PoppeDOI:10.1039/b206851f日期:——A series of hydroxymethyl ketones 4a–g were obtained from the corresponding halogenomethyl ketones 2a–gvia their transformation into acetoxymethyl ketones 3a–g by 18-crown-6 catalysed substitution with NaOAc followed by Novozyme 435™ catalysed ethanolysis. This convenient chemo-enzymatic route provides a mild, heavy-metal-free alternative to the direct α-hydroxylations of methyl ketones 1a–g.
表征谱图
-
氢谱1HNMR
-
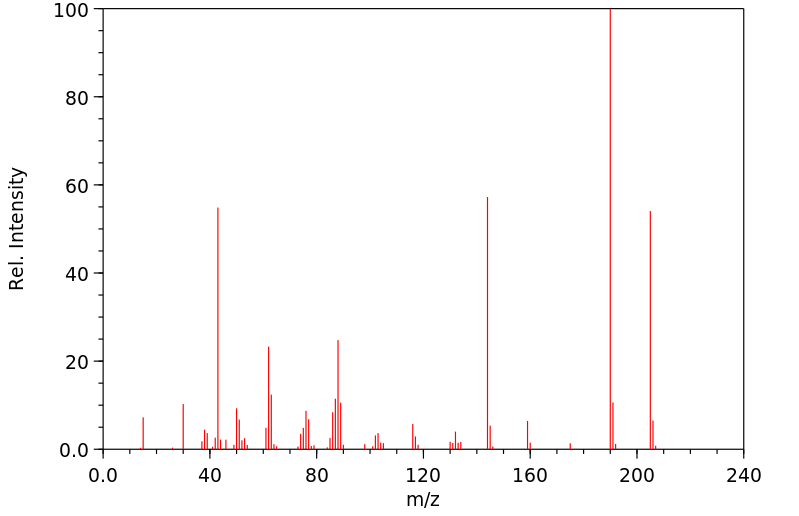
质谱MS
-
碳谱13CNMR
-
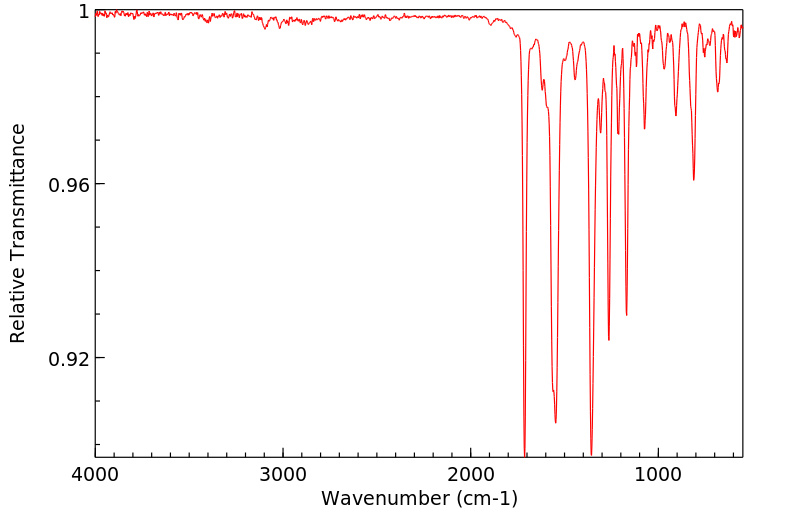
红外IR
-
拉曼Raman
-
峰位数据
-
峰位匹配
-
表征信息
同类化合物
()-2-(5-甲基-2-氧代苯并呋喃-3(2)-亚乙基)乙酸乙酯
顺式-1-((2-(5-氯-2-苯并呋喃基)-4-甲基-1,3-二氧戊环-2-基)甲基)-1H-1,2,4-三唑
顺式-1-((2-(5,7-二氯-2-苯并呋喃基)-4-乙基-1,3-二氧戊环-2-基)甲基)-1H-咪唑
顺式-1-((2-(2-苯并呋喃基)-4-乙基-1,3-二氧戊环-2-基)甲基)-1H-1,2,4-三唑
霉酚酸酯杂质B
雷美替胺杂质3
雷美替胺杂质22
雷美替胺杂质
间甲酚紫
间甲基苯基(苯并呋喃-2-基)甲醇
长管假茉莉素C
钠1,4-二[(2-乙基己基)氧基]-1,4-二氧代-2-丁烷磺酸酯-3,3-二(4-羟基苯基)-2-苯并呋喃-1(3H)-酮(1:1:1)
金霉素
酪氨酸,b-羰基-
酞酸酐-d4
酚酞二丁酸酯
酚酞
酚红钠
酚红
邻苯二甲酸酐与马来酸酐,甘氨酰蜡素和二乙二醇的聚合物
邻苯二甲酸酐与己二醇的聚合物
邻苯二甲酸酐与三甘醇异壬醇的聚合物
邻苯二甲酸酐与2-乙基-2-羟甲基-1,3-丙二醇和2,5-呋喃二酮的聚合物
邻苯二甲酸酐与2-乙基-2-羟甲基-1,3-丙二醇、2,5-呋喃二酮和2-乙基己酸苯甲酸酯的聚合物
邻苯二甲酸酐-13C6
邻苯二甲酸酐-4-硼酸频哪醇酯
邻苯二甲酸酐,马来酸,二乙二醇,新戊二醇聚合物
邻甲酚酞二庚酸酯
邻甲酚酞二己酸酯
邻甲酚酞
贝康唑
表灰黄霉素
螺佐呋酮
螺[苯并呋喃-3(2H),4-哌啶]
螺[异苯并呋喃-1(3H),4’-哌啶]-3-酮
螺[异苯并呋喃-1(3H),4'-哌啶]-3-酮盐酸盐
螺[异苯并呋喃-1(3H),3’-吡咯烷]-3-酮
螺[1-苯并呋喃-2,1'-环丙烷]-3-酮
薄荷内酯
萘并[2,3-b]呋喃-8(4H)-酮,4a,5,6,7,8a,9-六氢-,顺-
莫罗卡尼
荨麻叶泽兰酮
荧光胺
苯酞-3-乙酸
苯酚,2-[3-(2-苯并呋喃基)-5,6-二氢-1,2,4-三唑并[3,4-b][1,3,4]噻二唑-6-基]-
苯酐二乙二醇共聚物
苯酐
苯甲酸,2-[(1,3-二羰基丁基)氨基]-,甲基酯
苯甲酸,2,2-二(羟甲基)丙烷-1,3-二醇,异苯并呋喃-1,3-二酮
苯甲酰氯化,3-甲氧基-4-甲基-