thiophene-2-carbonyl fluoride | 32178-51-1
中文名称
——
中文别名
——
英文名称
thiophene-2-carbonyl fluoride
英文别名
2-Thiophenecarbonyl fluoride
CAS
32178-51-1
化学式
C5H3FOS
mdl
——
分子量
130.143
InChiKey
BUURGRNLCLOJBW-UHFFFAOYSA-N
BEILSTEIN
——
EINECS
——
-
物化性质
-
计算性质
-
ADMET
-
安全信息
-
SDS
-
制备方法与用途
-
上下游信息
-
文献信息
-
表征谱图
-
同类化合物
-
相关功能分类
-
相关结构分类
计算性质
-
辛醇/水分配系数(LogP):2
-
重原子数:8
-
可旋转键数:1
-
环数:1.0
-
sp3杂化的碳原子比例:0.0
-
拓扑面积:45.3
-
氢给体数:0
-
氢受体数:3
SDS
反应信息
-
作为反应物:描述:thiophene-2-carbonyl fluoride 在 4-叔丁基-2,6-二甲基苯基三氟化硫 、 pyridine hydrofluoride 作用下, 以 neat (no solvent) 为溶剂, 反应 24.0h, 以13%的产率得到2-(三氟甲基)噻吩参考文献:名称:无溶剂条件下使用 FLOOLEAD®/Olah 试剂将酰基氟脱氧氟化为三氟甲基化合物摘要:已经开发出一种能够从酰基氟化物形成三氟甲基化合物的新方案。 FLOOLEAD ®和Olah's 试剂在70 °C 无溶剂条件下结合,引发了酰基氟化物的显着脱氧氟化,并产生了相应的高产率三氟甲基产物(高达99%)。该策略对含有芳酰基、(杂芳基)酰基或脂肪族酰基部分的各种酰氟表现出极大的耐受性,从而提供了良好至优异的三氟甲基产物产率。合成的类药分子也在相同的反应条件下转化为相应的三氟甲基化合物。提出了反应机理。DOI:10.3762/bjoc.16.254
-
作为产物:描述:2-噻吩甲酸 在 N-溴代丁二酰亚胺(NBS) 、 三苯基膦 、 triethylamine tris(hydrogen fluoride) 作用下, 以 二氯甲烷 为溶剂, 以70 %的产率得到thiophene-2-carbonyl fluoride参考文献:名称:1,3-烯炔的高选择性 1,4-二酰化/环异构化:多取代呋喃的从头合成策略摘要:开发用于快速组装生物学相关多取代呋喃的从头合成策略是一项有吸引力但具有挑战性的任务。在此,我们公开了NHC和有机光催化助催化的三组分自由基1,4-二酰基化/环异构化级联过程,该过程容易获得1,3-烯炔,该过程提供了一种有效且直接的途径来获得各种多取代呋喃,具有良好的产率和优异的区域性- 和化学选择性。该反应条件温和,底物范围广,官能团兼容性好。DOI:10.1021/acs.orglett.3c03450
文献信息
-
Synthesis of 2-Substituted Propenes by Bidentate Phosphine-Assisted Methylenation of Acyl Fluorides and Acyl Chlorides with AlMe<sub>3</sub>作者:Xiu Wang、Zhenhua Wang、Yuya Asanuma、Yasushi NishiharaDOI:10.1021/acs.orglett.9b01059日期:2019.5.17methylenation of acyl fluorides and acyl chlorides with substituted with aryl, alkenyl, and alkyl groups trimethylaluminum afforded an array of 2-substituted propene derivatives. The addition of a catalytic amount of DPPM increased an efficiency of the reactions. Trimethylaluminum as the methylenation reagent not only eliminates the presynthesis of methylene transfer reagent, but provides an efficient method for
-
Direct α-Acylation of Alkenes via N-Heterocyclic Carbene, Sulfinate, and Photoredox Cooperative Triple Catalysis作者:Kun Liu、Armido StuderDOI:10.1021/jacs.1c01022日期:2021.4.7excellent functional group tolerance. Mechanistic studies reveal that these cascades proceed through a sequential radical addition/coupling/elimination process. In contrast to known triple catalysis processes that operate via two sets of interwoven catalysis cycles, in the introduced process, all three cycles are interwoven.N-杂环卡宾(NHC)催化已成为现代合成化学中的多功能工具。进一步增加了复杂性,引入了几种通过双催化进行的过程,其中 NHC 有机催化剂与第二催化部分协同作用,显着扩大了反应范围。在生物转化中,通常使用多重催化来获取复杂的天然产物。在该策略的指导下,最近研究了三重催化,其中三种不同的催化模式合并在一个过程中。在本通讯中,报道了使用 NHC、亚磺酸盐和光氧化还原协同三重催化对各种烯烃与芳酰氟进行直接 α-C-H 酰化。该方法可以以中等至高产率制备具有优异官能团耐受性的α-取代乙烯基酮。机理研究表明,这些级联通过连续的自由基加成/偶联/消除过程进行。与通过两组交织的催化循环操作的已知三重催化过程相比,在所引入的过程中,所有三个循环都是交织的。
-
Rapid and column-free syntheses of acyl fluorides and peptides using <i>ex situ</i> generated thionyl fluoride作者:Cayo Lee、Brodie J. Thomson、Glenn M. SammisDOI:10.1039/d1sc05316g日期:——Thionyl fluoride (SOF2) was first isolated in 1896, but there have been less than 10 subsequent reports of its use as a reagent for organic synthesis. This is partly due to a lack of facile, lab-scale methods for its generation. Herein we report a novel protocol for the ex situ generation of SOF2 and subsequent demonstration of its ability to access both aliphatic and aromatic acyl fluorides in 55–98%亚硫酰氟 (SOF 2 ) 于 1896 年首次分离出来,但随后关于其用作有机合成试剂的报道不到 10 例。这部分是由于缺乏简便的、实验室规模的方法来生成它。在这里,我们报告了一种用于异地生成 SOF 2的新协议随后证明了它在温和条件和短反应时间下以 55-98% 的分离产率获得脂肪族和芳香族酰氟的能力。我们进一步证明了它在氨基酸偶联方面的能力,采用一锅无柱策略,以 65-97% 的分离产率提供相应的二肽,且差向异构化最少甚至没有。广泛的范围允许广泛的保护基团以及天然和非天然氨基酸。最后,我们证明了这种新方法可用于连续液相肽合成 (LPPS),以 14-88% 的收率提供三肽、四肽、五肽和十肽,而无需柱层析。我们还证明了这种新方法适用于固相肽合成 (SPPS),以 80-98% 的产率提供二肽和五肽。
-
Cooperative NHC and Photoredox Catalysis for the Synthesis of β‐Trifluoromethylated Alkyl Aryl Ketones作者:Qing‐Yuan Meng、Nadine Döben、Armido StuderDOI:10.1002/anie.202008040日期:2020.11.2Despite the great potential of radical chemistry in organic synthesis, N‐heterocyclic carbene (NHC)‐catalyzed reactions involving radical intermediates are not well explored. This communication reports the three‐component coupling of aroyl fluorides, styrenes and the Langlois reagent (CF3SO2Na) to give various β‐trifluoromethylated alkyl aryl ketones with good functional group tolerance in moderate to high
-
Base-free nickel-catalysed decarbonylative Suzuki–Miyaura coupling of acid fluorides作者:Christian A. Malapit、James R. Bour、Conor E. Brigham、Melanie S. SanfordDOI:10.1038/s41586-018-0628-7日期:2018.11Suzuki–Miyaura-type reactions to proceed without an exogenous base12–14. Here we use this approach to develop a nickel-catalysed coupling of aryl boronic acids with acid fluorides15–17, which are formed in situ from readily available carboxylic acids18–22. This combination of catalyst and electrophile enables a mechanistic manifold in which a ‘transmetallation-active’ aryl nickel fluoride intermediate is generated有机硼亲核试剂与芳基卤化物亲电子试剂的 Suzuki–Miyaura 交叉偶联是有机化学和药物化学中应用最广泛的碳-碳键形成反应之一 1,2。与这些转化相关的一个关键挑战是它们通常需要添加外源碱,其作用是使有机硼亲核试剂和金属催化剂之间发生金属转移3。这一要求限制了反应的底物范围,因为添加的碱会促进许多有机硼底物的竞争性分解 3-5。因此,相当多的研究集中在减轻碱基介导的副反应的策略上 6-12。以前的努力主要集中在设计战略性掩蔽的有机硼试剂(以减缓碱介导的分解)6-8 或开发高活性钯预催化剂(以加速与碱介导的分解途径相关的交叉偶联)10-12。一种有吸引力的替代方法涉及确定催化剂和亲电子试剂的组合,使铃木-宫浦型反应能够在没有外源碱基的情况下进行 12-14。在这里,我们使用这种方法来开发镍催化的芳基硼酸与酰基氟的偶联 15-17,后者由容易获得的羧酸原位形成 18-22。催化剂和亲电子
表征谱图
-
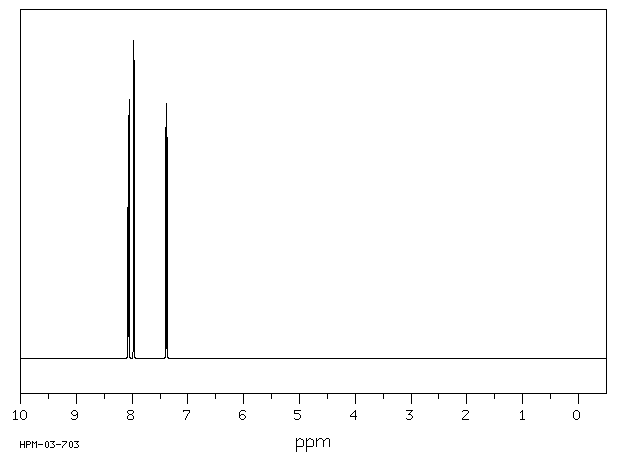
氢谱1HNMR
-
质谱MS
-
碳谱13CNMR
-
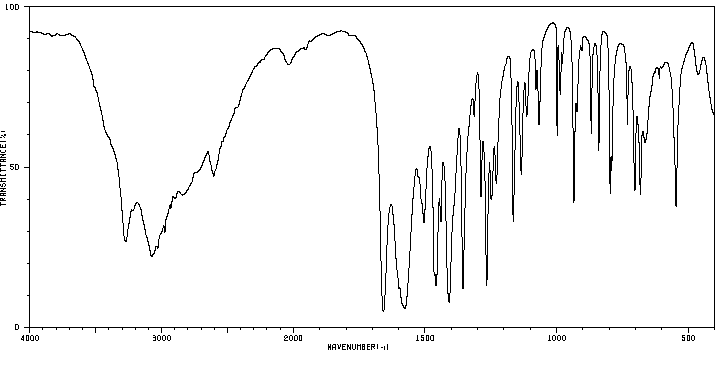
红外IR
-
拉曼Raman
-
峰位数据
-
峰位匹配
-
表征信息
同类化合物
阿罗洛尔
阿替卡因
阿克兰酯
锡烷,(5-己基-2-噻吩基)三甲基-
邻氨基噻吩(2盐酸)
辛基5-(1,3-二氧戊环-2-基)-2-噻吩羧酸酯
辛基4,6-二溴噻吩并[3,4-b]噻吩-2-羧酸酯
辛基2-甲基异巴豆酸酯
血管紧张素IIAT2受体激动剂
葡聚糖凝胶LH-20
苯螨噻
苯并[c]噻吩-1-羧酸,5-溴-4,5,6,7-四氢-3-(甲硫基)-4-羰基-,乙基酯
苯并[b]噻吩-2-胺
苯并[b]噻吩-2-胺
苯基-[5-(4,4,5,5-四甲基-[1,3,2]二氧杂硼烷-2-基)-噻吩-2-基亚甲基]-胺
苯基-(5-氯噻吩-2-基)甲醇
苯乙酸,-α--[(1-羰基-2-丙烯-1-基)氨基]-
苯乙酰胺,3,5-二氨基-a-羟基-2,4,6-三碘-
苯乙脒,2,6-二氯-a-羟基-
腈氨噻唑
聚(3-丁基噻吩-2,5-二基),REGIOREGULAR
硝呋肼
硅烷,(3-己基-2,5-噻吩二基)二[三甲基-
硅噻菌胺
盐酸阿罗洛尔
盐酸阿罗洛尔
盐酸多佐胺
甲酮,[5-(1-环己烯-1-基)-4-(2-噻嗯基)-1H-吡咯-3-基]-2-噻嗯基-
甲基5-甲酰基-4-甲基-2-噻吩羧酸酯
甲基5-乙氧基-3-羟基-2-噻吩羧酸酯
甲基5-乙基-3-肼基-2-噻吩羧酸酯
甲基5-(氯甲酰基)-2-噻吩羧酸酯
甲基5-(氯乙酰基)-2-噻吩羧酸酯
甲基5-(氨基甲基)噻吩-2-羧酸酯
甲基5-(4-甲氧基苯基)-2-噻吩羧酸酯
甲基5-(4-甲基苯基)-2-噻吩羧酸酯
甲基5-(1,3-二氧戊环-2-基)-2-噻吩羧酸酯
甲基4-硝基-2-噻吩羧酸酯
甲基4-氰基-5-(4,6-二氨基吡啶-2-基)偶氮-3-甲基噻吩-2-羧酸酯
甲基4-氨基-5-(甲硫基)-2-噻吩羧酸酯
甲基4-{[(2E)-2-(4-氰基苯亚甲基)肼基]磺酰}噻吩-3-羧酸酯
甲基4-(氯甲酰基)-3-噻吩羧酸酯
甲基4-(氨基磺酰基氨基)-3-噻吩羧酸酯
甲基3-甲酰氨基-4-甲基-2-噻吩羧酸酯
甲基3-氨基-5-异丙基-2-噻吩羧酸酯
甲基3-氨基-5-(4-溴苯基)-2-噻吩羧酸酯
甲基3-氨基-4-苯基-5-(三氟甲基)-2-噻吩羧酸酯
甲基3-氨基-4-氰基-5-甲基-2-噻吩羧酸酯
甲基3-氨基-4-丙基-2-噻吩羧酸酯
甲基3-[[(4-甲氧基苯基)亚甲基氨基]氨基磺酰基]噻吩-2-羧酸酯