氩 | 7440-37-1
物质功能分类
-
物化性质
-
计算性质
-
ADMET
-
安全信息
-
SDS
-
制备方法与用途
-
上下游信息
-
文献信息
-
表征谱图
-
同类化合物
-
相关功能分类
-
相关结构分类
物化性质
-
熔点:-189.2 °C(lit.)
-
沸点:-185.7 °C(lit.)
-
密度:1.784(0℃)
-
蒸气密度:1.38 (21 °C, vs air)
-
溶解度:微溶于H2O
-
介电常数:1.5(-191℃)
-
LogP:0.740 (est)
-
物理描述:Argon appears as a colorless odorless noncombustible gas. Heavier than air and can asphyxiate by displacement of air. Exposure of the container to prolonged heat or fire can cause it to rupture violently and rocket . If liquefied, contact of the very cold liquid with water may cause violent boiling. If the water is hot, there is the possibility that a liquid "superheat" explosion may occur. Contacts with water in a closed container may cause dangerous pressure to build.
-
颜色/状态:Colorless monatomic gas
-
气味:Odorless
-
味道:Tasteless
-
蒸汽密度:1.38 (Air = 1)
-
汽化热:Liquid (normal BP): 6469 J/mol; Solid: (triple pt): 7.785 kJ/mol.
-
稳定性/保质期:
计算性质
-
辛醇/水分配系数(LogP):0.0
-
重原子数:1
-
可旋转键数:0
-
环数:0.0
-
sp3杂化的碳原子比例:0.0
-
拓扑面积:0
-
氢给体数:0
-
氢受体数:0
ADMET
安全信息
-
危险等级:2.2
-
安全说明:S38
-
WGK Germany:-
-
危险品运输编号:UN 1006 2.2
-
RTECS号:CF2300000
-
海关编码:2804210000
-
包装等级:O53
-
危险类别:2.2
-
危险标志:GHS04
-
危险性描述:H280
-
危险性防范说明:P410 + P403
-
储存条件:储存于阴凉、通风的不燃气体专用库房。远离火种和热源,库温不宜超过30℃。应与易(可)燃物分开存放,切忌混储。储区应配备泄漏应急处理设备。
制备方法与用途
氩(Argon)的化学符号是Ar,原子序数为18,位于周期表第18族,是一种稀有气体。它占大气体积0.934%(约9340 ppmv),是地球大气层第三多的气体。与水蒸气相比,其含量约为前者的两倍(平均4000 ppmv左右),而二氧化碳浓度仅为它的23倍,氖元素则为500倍以上。在地壳中,氩是最丰富的惰性元素之一,占比0.00015%。已知的氩同位素共有14种,从氩-33到氩-46不等。地球大气中的大部分氩元素来自钾-40衰变过程产生的氩-40。在宇宙中,最常见的同位素是氩-36,因为它主要由超新星核聚变产生。
发现历史1785年,亨利·卡文迪什怀疑稀有气体存在于大气中的一部分。1849年,在伦敦大学学院,约翰·斯特拉特(第三代瑞利男爵)和威廉·拉姆齐通过去除氧气、二氧化碳、水及氮的干净空气样本,首次成功分离出氩气。这一过程揭示了空气中存在不同于常规氮气的新气体,并且他们最终确认这是另一种未被发现的元素。
1882年,H. F. Newall与沃尔特·诺尔·赫特利在研究中偶然发现了氩气,由于新出现的光谱不对应当时已知的任何元素。直至1957年,氩的化学符号由“A”改为“Ar”。
来源氩是地球上第56最丰富的元素,在大气中的含量最高。唯一来源即为大气本身,其中氩占约0.934%。
应用当需要惰性气氛时使用氩气。它可以单独或与其他惰性气体混合用于充填电灯泡、荧光灯管、激光器等设备中。通过替换白炽灯泡中的氧气可防止细丝被腐蚀,同时它也用作焊接的非氧化性保护气体和钢的脱碳剂,在半导体晶体生长过程中提供惰性气氛。
制备氩气可通过液态空气分馏制得,是最常见的商业化方法之一。在该过程中,氩气会在固定温度下沸腾后被收集,并通过木炭进一步纯化以滤除氦及其他气体,从而大量产生高纯度的氩气。
健康影响虽然氩是无毒的,但它作为一种窒息性气体,吸入过量可能导致呼吸困难。储存和运输时需注意低温干燥环境及轻装轻卸原则,并且使用水作为灭火剂。
类别与特性- 类别:有害气体
- 急性毒性:仅有窒息性毒性
- 爆炸物危险特性:钢瓶高温下可能发生爆炸
- 可燃性危险特性:不燃,但可导致窒息
- 储运特性:库房需通风、低温干燥,并轻装轻卸
- 灭火剂:水
总结了氩的基本信息及其应用和制备方法。需要注意的是,在储存与使用过程中要严格遵守安全规定以保障人员健康及设备安全。
反应信息
-
作为反应物:描述:氩 在 HF-pyridine polymer 作用下, 以 solid matrix 为溶剂, 生成 argon hydrogen fluoride参考文献:名称:含稀有气体分子与氮的相互作用:HArF⋯N2、HKrF⋯N2 和 HKrCl⋯N2 配合物的矩阵分离和从头算研究摘要:已通过计算和实验研究了 HArF、HKrF 和 HKrCl 与氮分子的配合物。在计算的帮助下,实验数据可以解释为显示存在两种复杂的配置,一种是线性的,一种是弯曲的。所研究分子的振动特性对分子间相互作用非常敏感,并且络合会导致 H-Ar 和 H-Kr 伸缩频率出现异常大的蓝移(HKrCl > 100 cm-1),尤其是对于线性构型。没有零点能量校正的相互作用能在 400 到 800 cm-1 之间。根据能量分解方案,静电力提供了线性复杂构型中最重要的相互作用。对于弯曲的复合体,DOI:10.1063/1.1575198
-
作为产物:描述:以 gaseous matrix 为溶剂, 生成 氩参考文献:名称:Spectroscopic study of dissociative recombination between Ar2 + ions and electrons摘要:DOI:10.1007/bf00662781
-
作为试剂:描述:吡啶 、 3-甲基吡啶 、 (Cyanomethylidyne)oxidanium 在 氩 作用下, 生成 N-Cyan-pyridinium 、 pyridin-1-ium 、 3-Methylpyridin-1-ium-1-carbonitrile 、 、 、参考文献:名称:Relative cyanide cation (+CN) affinities of pyridines determined by the kinetic method using multiple-stage (MS3) mass spectrometry摘要:在五重四极杆质谱仪中发生的离子-分子反应被用来生成和表征其中一种或两种吡啶分子通过+CN阳离子结合的离子。氰化物阳离子与吡啶的氮原子强烈结合,生成单加合物,该加合物经历吡啶交换反应,并从中以低丰度生成双吡啶加合物。二聚离子具有两种结构,松散结合和共价结合,并且两者断裂都会产生构成氰化物结合的单体。对于由间位取代的烷基吡啶组成的二聚体,使用动力学方法测得的相对氰化物阳离子亲和力与文献中的相对质子亲和力值之间存在定量相关性。这些二聚体类似物与相应的H+-和Cl+-结合的二聚体断裂相似,基于此,它们被赋予相似的结构,即松散结合的形式Py1+CNPy2。半经验分子轨道计算表明,两个吡啶都与氰化物阳离子的碳原子结合。假设活化的氰化物结合二聚体的有效温度与相应的Cl+-和H+-结合二聚体相似,则相对+CN阳离子亲和力估计为1.5 kcal mol−1 (3-MePy),1.7 kcal mol–1 (4-MePy),2.6 kcal mol-1 (3-EtPy),3.5 kcal mol-1 (3-n-BuPy)和3.6 kcal mol–1 (3,5-diMePy),所有这些都是相对于吡啶表示的(1 kcal = 4.184 kJ)。在假设+CN二聚体有效温度为600 K的情况下,推导出相对+CN亲和力与相对质子亲和力(PA)之间的线性关系,即Δ +CN亲和力(kcal mol-1)= 0.78(ΔPA)。估计的不确定性为0.5 kcal mol-1。相对于相应的Cl+亲和力,吡啶对的相对+CN亲和力低约1 kcal mol-1。其中一个吡啶是间氯或对烷基取代的二聚体具有共价结合、环碳取代的结构,其中+CN基团连接到吡啶氮,第二个吡啶分子连接到环碳。这些异构二聚体的断裂会产生相应的单体以及其他次要离子,但氰化物阳离子在两个吡啶之间的分布与Cl+亲和力或质子亲和力没有相关性。在3-甲基吡啶-3-正丁基吡啶和4-甲基吡啶-吡啶氰化物阳离子加合物的特殊情况下,生成了松散结合的二聚体和共价结合的加合物,并通过它们的断裂行为进行区分。在半经验AMI计算中还获得了形成共价结合、环碳取代结构的证据。DOI:10.1002/jms.1190300128
文献信息
-
Oxime derivatives for the treatment of dyslipidemia and hypercholesteremia申请人:——公开号:US20030083357A1公开(公告)日:2003-05-01The present invention relates to compounds of Formula (I) which may be useful in the treatment of diseases, such as, metabolic disorders, dyslipidemia and/or hyperchloesterolemia: 1本发明涉及Formula (I)的化合物,可能在治疗疾病,如代谢紊乱、血脂异常和/或高胆固醇血症方面有用:
-
Heterocyclic derivatives for the treatment of diabetes and other diseases申请人:Maxia Pharmaceuticals, Inc.公开号:US06515003B1公开(公告)日:2003-02-04The present invention relates to certain substituted heterocycles of Formula (I) which are useful in the treatment of diseases related to lipid and carbohydrate metabolism, such as type 2 diabetes, adipocyte differentiation, uncontrolled proliferation, such as lymphoma, Hodgkin's Disease, leukemia, breast cancer, prostate cancer or cancers in general; and inflammation, such as osteoarthritis, rheumatoid arthritis, Crohn's Disease or Inflammatory Bowel Disease.
-
Inhibitors of farnesyl-protein transferase申请人:Merk & Co., Inc.公开号:US05872135A1公开(公告)日:1999-02-16The present invention comprises analogs of the CAAX motif of the protein Ras that is modified by farnesylation in vivo. These CAAX analogs inhibit farnesyl-protein transferase. Furthermore, these CAAX analogues differ from those previously described as inhibitors of farnesyl-protein transferase in that they do not have a thiol moiety. The lack of the thiol offers unique advantages in terms of improved pharmacokinetic behavior in animals, prevention of thiol-dependent chemical reactions, such as rapid autoxidation and disulfide formation with endogenous thiols, and reduced systemic toxicity. Further contained in this invention are chemotherapeutic compositions containing these farnesyl transferase inhibitors and methods for their production.
-
Macrocyclic tetraazacyclododecane conjugates and their use as diagnostic申请人:The Dow Chemical Company公开号:US05756065A1公开(公告)日:1998-05-26A group conjugates having a functionalized polyaminocarboxylate chelant that form complexes with rare earth-type metal ions, covalently attached to an antibody or antibody fragment, can be used for therapeutic and/or diagnostic purposes.
-
7-oxabicycloheptane substituted keto-amide prostaglandin analogs useful申请人:E. R. Squibb & Sons, Inc.公开号:US04639461A1公开(公告)日:1987-01-277-Oxabicycloheptane substituted keto-amide prostaglandin analogs are provided having the structural formula ##STR1## wherein m is 0 to 4; A is --CH.dbd.CH-- or --CH.sub.2 --CH.sub.2 --; n is 1 to 5; Q is --CH.dbd.CH--, --CH.sub.2 --, ##STR2## or a single bond; R is CO.sub.2 H, CO.sub.2 alkyl, CO.sub.2 alkali metal, CO.sub.2 polyhydroxyamine salt, ##STR3## wherein R.sup.4 and R.sup.5 are the same or different and are H, lower alkyl, hydroxy, lower alkoxy or aryl, at least one of R.sup.4 and R.sup.5 being other than hydroxy and lower alkoxy; p is 1 to 4; R.sup.1 is H or lower alkyl; and R.sup.2 is H, lower alkyl, lower alkenyl, aryl, arylalkyl, cycloalkyl or cycloalkylalkyl. The compounds are cardiovascular agents useful, for example, in the treatment of thrombotic disease.提供了具有结构式##STR1##的7-氧代双环庚烷取代酮酰胺前列腺素类似物,其中m为0至4;A为--CH.dbd.CH--或--CH.sub.2 --CH.sub.2 --;n为1至5;Q为--CH.dbd.CH--,--CH.sub.2 --,##STR2##或单键;R为CO.sub.2 H,CO.sub.2烷基,CO.sub.2碱金属,CO.sub.2多羟胺盐,##STR3##其中R.sup.4和R.sup.5相同或不同,为H,低烷基,羟基,低烷氧基或芳基,R.sup.4和R.sup.5中至少有一个不是羟基和低烷氧基;p为1至4;R.sup.1为H或低烷基;R.sup.2为H,低烷基,低烯基,芳基,芳基烷基,环烷基或环烷基烷基。这些化合物是心血管药物,例如,在治疗血栓性疾病方面有用。
表征谱图
-
氢谱1HNMR
-
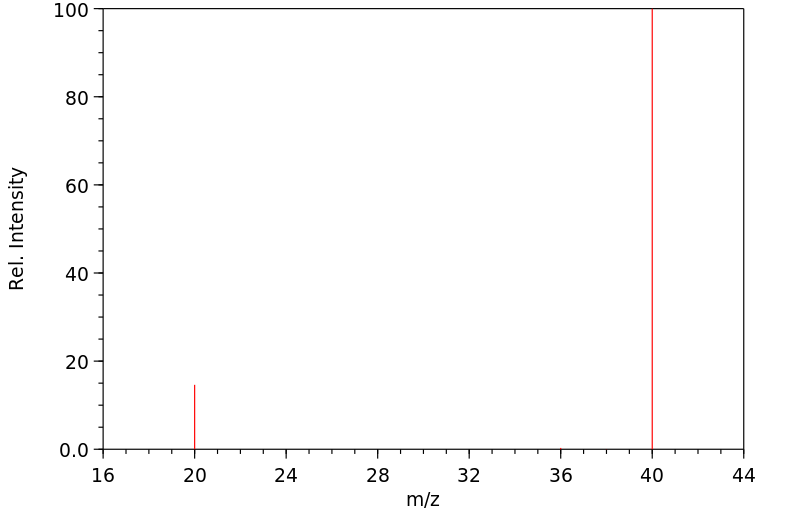
质谱MS
-
碳谱13CNMR
-
红外IR
-
拉曼Raman
-
峰位数据
-
峰位匹配
-
表征信息