氙气 | 7440-63-3
物质功能分类
-
物化性质
-
计算性质
-
ADMET
-
安全信息
-
SDS
-
制备方法与用途
-
上下游信息
-
文献信息
-
表征谱图
-
同类化合物
-
相关功能分类
-
相关结构分类
物化性质
-
熔点:-111.79°C
-
沸点:bp -108.13°
-
密度:1100 kg/m3; d0 (101.3 kPa) 5.8971 kg/m3; d (normal bp) 11 kg/m3; d (normal bp) 3057 kg/m3; d (triple pt) 3084 kg/m3; d (triple pt) 3540 kg/m3
-
溶解度:微溶于H2O
-
LogP:1.280 (est)
-
物理描述:Xenon appears as a colorless odorless gas. Noncombustible. Heavier than air. May asphyxiate by the displacement of air. Under prolonged exposure to fire or heat containers may rupture violently and rocket.
-
蒸汽密度:Relative vapor density (air = 1): 4.5
-
稳定性/保质期:
- 稳定性:稳定。
- 聚合危害:不聚合。
计算性质
-
辛醇/水分配系数(LogP):0.0
-
重原子数:1
-
可旋转键数:0
-
环数:0.0
-
sp3杂化的碳原子比例:0.0
-
拓扑面积:0
-
氢给体数:0
-
氢受体数:0
ADMET
安全信息
-
危险等级:2.2
-
危险品标志:T
-
安全说明:S38,S9
-
WGK Germany:3
-
危险品运输编号:UN 2036 2.2
-
RTECS号:ZE1280000
-
包装等级:O53
-
危险类别:2.2
-
危险标志:GHS04
-
危险性描述:H280
-
危险性防范说明:P410 + P403
-
储存条件:储存于阴凉、通风的不燃气体专用库房。远离火种、热源,库温不宜超过30℃。应与易(可)燃物分开存放,切忌混储。储区应备有泄漏应急处理设备。
制备方法与用途
简介 氙是一种化学元素,化学符号为Xe,原子序数为54。它是一种无色、无味的惰性气体,在地球大气层中含量极低。尽管它的化学活性较低,但仍然能够进行一些化学反应,例如形成六氟合铂酸氙——首个被合成的稀有气体化合物。自然产生的氙由7种稳定同位素组成,并且还有40多种放射性衰变的不稳定同位素。这些同位素的比例对研究太阳系早期历史具有重要意义。
发现历史 英国化学家威廉·拉姆齐和莫里斯·特拉弗斯在1898年7月12日,在蒸发液态空气后的残留物中发现了氙,并建议将其命名为“xenon”,源自希腊语“ξένος”(xenos),意为外来者、陌生人或异客。1902年,拉姆齐估计氙在地球大气中的含量约为百万分之二。
来源 氙是地球大气层中的一种微量气体,其浓度约为每10亿个空气分子中有87±1个氙分子(即百万分之一)。某些天然矿泉也会释放出含有氙的气体。氙可以通过空气分离过程中作为副产品获得。
应用 氙的应用领域广泛:
- 可用于闪光灯和弧灯中;
- 用作全身麻醉药;
- 最早的准分子激光设计使用氙二聚体(Xe2)作为激光介质,而早期激光设计也常使用氙闪光灯进行抽运。
- 氙还可以用来寻找大质量弱相互作用粒子或作为航天器离子推力器的推进剂。
制备 氙可通过液化和分馏从空气中获得。首先将空气液化,分离出液氧后稀有气体就会富集于其中。通过进一步精馏,可以分离出含氙的混合液。173K时使用活性炭吸附可使Ar、Kr与Xe被吸附;改变温度及其他条件后即可得到纯净的氙。
安全信息 氙气是一种惰性气体,无毒且不可燃。某些化合物是有毒和可能爆炸性的,但通常我们不会经常接触它们。在操作或处理过程中应特别小心。
化学性质 氙是无色气体,不能燃烧也不助燃。它能吸收X射线。气体相对密度为5.887±0.009(100℃下液态相对密度为3.52),固体相对密度在-140℃时为2.7。临界温度为16.6℃,临界压力为58.2×100 Pa,临界密度为1.155。氙是天然稀有气体中相对原子质量最大、密度最大的元素之一,在稀有气体中已经制得的化合物以氙最多。
用途 广泛应用于电子和电光源行业。与相同功率的充氩灯泡相比,使用氙气填充的灯泡具有更高的发光率、较小体积、更长寿命以及更低能耗等优点。由于透雾能力强,常用于机场、车站、码头的导航灯光中。氙灯凹面聚光后可以生成高达2500℃的高温,适用于焊接或切割难熔金属如钛和钼等。在医学领域,氙是一种没有副作用的深度麻醉剂,并且也被用作X光摄影中的造影剂。
生产方法 空分法从空气分离装置中提取氪、氙混合气,经过精馏处理以去除贫氪并清除碳氢化合物及其他杂质后可制得99.99%纯度的氙。也可通过合成氨尾气中的氙进行回收,在此过程中首先将含有的氪、氙在甲烷塔液态甲烷中提纯后经精馏、洗涤、除氧等步骤后制成高纯度氙。
类别 有害气体
毒性分级 低毒
急性毒性 吸入-小鼠 TCL0 67000 ppm
爆炸物危险特性 钢瓶高热可爆
可燃性危险特性 不燃; 可令人窒息
储运特性 库房通风低温干燥;轻装轻卸
反应信息
-
作为反应物:参考文献:名称:低压Tesla线圈放电中氟化氙和氯化氙的形成摘要:DOI:10.1021/j100391a030
-
作为产物:描述:参考文献:名称:氙和氡的氟化合物摘要:氙气和氟很容易结合。四氟化氙是一种无色结晶材料,在室温下稳定。已经证明存在至少一种其他氟化物和两种氟氧化物。最重的“惰性气体”氡也会与氟反应,产生一种比四氟化氙更不易挥发的化合物。DOI:10.1126/science.138.3537.136
-
作为试剂:参考文献:名称:甲烷和氙气基质中的自由基对氢原子的光消除作用。CH3O2的光分解摘要:DOI:10.1021/j100395a025
文献信息
-
The theoretical and experimental distinguishing of photoassociation into the XeCl(B) state作者:E.B. Gordon、V.G. Egorov、S.E. Nalivaiko、V.S. Pavlenko、O.S. RzhevskyDOI:10.1016/0009-2614(95)00721-f日期:1995.8excitation into the XeCl(B) state in conditions when the equilibrium between nonexcited XeCl(X) molecules and free Xe and Cl atoms does not have time to be completed. The experimentally obtained ratio of intensities for the bb- and fb-transitions, amounting to 1.8–3.3, is in good agreement with the calculations. These experiments enabled estimation of the rate constant for XeCl(X) state dissociation in严格考虑束缚跃迁(bb)和自由束缚(fb)跃迁的过程,可以模拟XeCl(B)态的激发光谱。计算了bb吸收和光缔合的横截面,在λ = 308 nm附近的最大值处,分别为1.2×10 -16 cm 2和1.4×10 -38 cm 5, 分别。开发了一种实验方法,通过在未激发的XeCl(X)分子与自由Xe和Cl原子之间的平衡尚无时间完成的情况下,通过监测XeCl(B)状态的激发来区分fb-过渡贡献。实验获得的bb和fb跃迁强度比为1.8-3.3,与计算结果非常吻合。这些实验使得能够估计与Xe原子发生双分子碰撞时XeCl(X)状态解离的速率常数为(3-6)×10 -11 cm 3 s -1。
-
Energy disposal in the two-photon laser-assisted reaction in xenon and chlorine gas mixtures作者:J. Kohel、J. W. KetoDOI:10.1063/1.1324976日期:2000.12.15The two-photon laser assisted reaction (LAR) in low pressure xenon and chlorine gas mixtures has been studied over a broad range of excitation wavelengths in order to characterize the role of the entrance channel in determining the vibrational state distribution of the reaction products. We measure a high degree of vibrational excitation in the XeCl* product, confirming observations from previous studies已经在广泛的激发波长范围内研究了低压氙气和氯气混合物中的双光子激光辅助反应 (LAR),以表征入口通道在确定反应产物的振动状态分布中的作用。我们测量了 XeCl* 产品中的高度振动激发,证实了先前对 Xe+Cl2 碰撞对的 LAR 研究的观察结果 [Ku 等人,J. Phys。化学。87, 2989 (1983)],并与分子束实验中激光激发后观察到的振动冷准分子形成鲜明对比 [Boivineau 等人,Chem. 物理。莱特。128, 528 (1986)]。XeCl 准分子中的平均振动能量强烈依赖于激光波长,随着波长的减小而增加。而且,随着激光被调谐到更短的波长,随着 XeCl* 产物的振动,可以观察到来自反应的可用能量的增加部分。反应结果被解释为...
-
Identification by Raman spectroscopy of various weak oxygen-bridged donor–acceptor adducts of arsenic and antimony pentafluorides; a reversal of the usual Lewis acidities of these pentafluorides towards sulphuryl fluoride作者:Grace S. H. Chen、Jack PassmoreDOI:10.1039/dt9790001257日期:——compounds POF3, SO2, SOF2, and COF2 form 1 : 1 oxygen-bridged adducts with AsF5 and SbF5 as shown from their Raman spectra obtained at various temperatures. The base strength of the donors appears to decrease in the given order. Sulphuryl fluoride behaves as a still weaker base; however, Raman spectra show the formation of an oxygen-bridged 1 : 1 adduct with AsF5, but not SbF5, a reversal of the usual Lewis
-
Xe<sub>3</sub>OF<sub>3</sub><sup>+</sup>, a Precursor to a Noble-Gas Nitrate; Syntheses and Structural Characterizations of FXeONO<sub>2</sub>, XeF<sub>2</sub>·HNO<sub>3</sub>, and XeF<sub>2</sub>·N<sub>2</sub>O<sub>4</sub>作者:Matthew D. Moran、David S. Brock、Hélène P. A. Mercier、Gary J. SchrobilgenDOI:10.1021/ja105618w日期:2010.10.6from liquid N(2)O(4) below 0 °C. The crystal structure of XeF(2)·N(2)O(4) displayed weak interactions between the xenon atom of XeF(2) and the oxygen atoms of N(2)O(4). Quantum-chemical calculations have been used to assign the vibrational spectra of FXeONO(2), XeF(2)·HNO(3), and XeF(2)·N(2)O(4) and to better understand the nature of the interactions of HNO(3) and N(2)O(4) with XeF(2). The synthesis of已通过 NO(2)F 与 [FXeOXeFXeF][AsF(6)] 在 -50 °C 下反应合成氟化氙。通过低温 (14)N、(19)F 和 (129)Xe NMR 光谱在 SO(2)ClF 和 CH(3)CN 溶液中对其进行表征,并通过低温拉曼光谱 (- 160 °C) 和单晶 X 射线衍射 (-173 °C)。这些反应是使用自然丰度和 (18)O 富集的 [FXeOXeFXeF][AsF(6)] 和 (15)NO(2)F 进行的,以帮助 FXeONO(2) 的振动分配并建立可能的反应途径。拉曼光谱显示 FXe(16)ON((16)O(18)O) 与 XeF(2) 和 [NO(2)][AsF(6)] 一起形成,当 N(16) 过量时O(2)F 与 [FXe(18)OXeFXeF][AsF(6)] 反应。讨论了与这些发现一致的反应机制。晶体结构由分离良好的 FXeONO(2) 分子组成,这
-
Fluorescence excitation spectra of the XeCl(B, C) states in a supersonic jet作者:C. Jouvet、C. Lardeux-Dedonder、D. SolgadiDOI:10.1016/s0009-2614(89)87233-1日期:1989.4An electric discharge in a mixture of He, Xe and Cl2 (or CCl4) followed by a supersonic expansion produces cold XeCl molecules and allows the fluorescence excitation spectra of the XeCl(B, C) states to be recorded. The vibrational spectroscopic constants ωe and ωexe as well as the 00 transition energy of the C state have been measured.He,Xe和Cl 2(或CCl 4)的混合物中的放电随后超音速膨胀产生冷的XeCl分子,并允许记录XeCl(B,C)状态的荧光激发光谱。振动光谱常数ω Ë和ω Ë X ë以及0 0 C状态的跃迁能进行了测量。
表征谱图
-
氢谱1HNMR
-
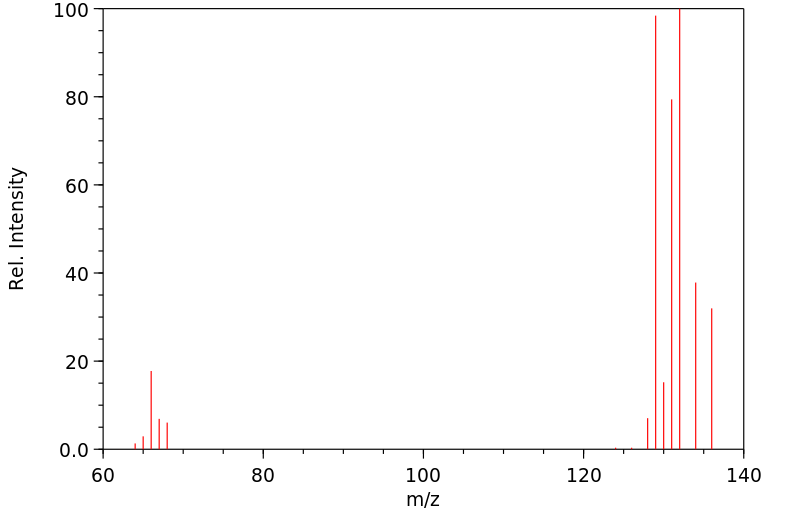
质谱MS
-
碳谱13CNMR
-
红外IR
-
拉曼Raman
-
峰位数据
-
峰位匹配
-
表征信息