二甲基-1,2,4,5-四嗪 | 1558-23-2
中文名称
二甲基-1,2,4,5-四嗪
中文别名
——
英文名称
3,6-dimethyl-1,2,4,5-tetrazine
英文别名
3,6-dimethyl-s-tetrazine;1,2,4,5-Tetrazine, 3,6-dimethyl-
CAS
1558-23-2
化学式
C4H6N4
mdl
——
分子量
110.118
InChiKey
DGLYTMLIGRQDPE-UHFFFAOYSA-N
BEILSTEIN
——
EINECS
——
-
物化性质
-
计算性质
-
ADMET
-
安全信息
-
SDS
-
制备方法与用途
-
上下游信息
-
文献信息
-
表征谱图
-
同类化合物
-
相关功能分类
-
相关结构分类
物化性质
-
熔点:74 °C (sublm)
-
沸点:262.1±23.0 °C(Predicted)
-
密度:1.160±0.06 g/cm3(Predicted)
计算性质
-
辛醇/水分配系数(LogP):-0.6
-
重原子数:8
-
可旋转键数:0
-
环数:1.0
-
sp3杂化的碳原子比例:0.5
-
拓扑面积:51.6
-
氢给体数:0
-
氢受体数:4
安全信息
-
危险性防范说明:P264,P280,P302+P352,P337+P313,P305+P351+P338,P362+P364,P332+P313
-
危险性描述:H315,H319
-
储存条件:温度在0-10°C之间;请避免加热。
SDS
上下游信息
反应信息
-
作为反应物:描述:参考文献:名称:川tr嗪有助于降低膦的水量:在Mitsunobu反应中的应用摘要:3,6-二取代-1,2,4,5-四嗪与水和PEt 3的反应形成相应的1,4-二氢四嗪和OPEt 3。因此,作为化学计量还原剂的PEt 3还原水,并且所得的两个还原当量用于使四嗪双重氢化。通过密度泛函计算评估了缺电子的四嗪与富电子的PR 3之间的各种可能的初始相互作用,包括电荷转移络合物,结果表明,所有这些能量使得它们在平衡状态下无法光谱检测到,但是其中之一是然而,建议将其作为观察到的氧化还原反应的中间体。这与Mitsunobu反应的关系,Mitsunobu反应吸收了讨论了在醇和羧酸向酯的转化过程中放出的水的各种成分,并希望在醇碳上进行转化。这样就可以进行修饰的Mitsunobu反应,用四嗪代替EtO 2 CN = NCO 2 Et(DEAD),其优点是二氢四嗪可以通过用O 2氧化而再循环为四嗪,而氢化DEAD则不可能。对于这种四嗪版本,无法检测到类似甜菜碱的中间体,但是其质子化形式具有特征,包括X射线结构和NMR光谱。DOI:10.1002/chem.201600913
-
作为产物:参考文献:名称:通过溶剂氢键实现 1,2,4,5-四嗪的选择性 N1/N4 1,4-环加成摘要:描述了一种前所未有的 1,2,4,5-四嗪的 1,4-环加成(vs 3,6-环加成),其中预制或原位生成的芳基共轭烯胺由六氟异丙醇 (HFIP) 的溶剂氢键促进,即在温和的反应条件(0.1 M HFIP,25 °C,12 小时)下进行。该反应构成了 1,2,4,5-四嗪的两个氮原子 (N1/N4) 之间的正式 [4 + 2] 环加成,然后是腈的正式逆 [4 + 2] 环加成损失和芳构化生成 1,2,4-三嗪衍生物。影响反应模式显着变化的因素,反应参数的优化,通过醛和酮原位生成烯胺实现的范围和简化,3,6-双(硫甲基)-1,2的反应范围,4,5-四嗪, 参与调查 1,2, 详细介绍了 4,5-四嗪以及对该反应的关键机理见解。鉴于其简单性和呼吸性,该研究建立了一种新方法,可在温和条件下从容易获得的起始材料中简单有效地一步合成 1,2,4-三嗪。尽管替代质子溶剂(例如,MeOH 与 HFIP)提供了传统DOI:10.1021/jacs.0c09775
-
作为试剂:描述:(E)-cyclooct-2-en-1-yl (4-nitrophenyl)carbonate 在 二甲基-1,2,4,5-四嗪 、 甲酸 作用下, 以 乙腈 为溶剂, 反应 1.0h, 生成 对硝基苯酚参考文献:名称:[EN] BIO-ORTHOGONAL DRUG ACTIVATION
[FR] ACTIVATION DE MÉDICAMENT BIO-ORTHOGONALE摘要:揭示了一种用于给予和激活前药的工具包。该工具包包括一个掩蔽基团,直接或间接地连接到一个触发基团,该触发基团又连接到一种药物,以及一个用于触发基团的激活剂。触发基团包括一个二烯烃,激活剂包括一个二烯,其中二烯烃是一个八元非芳香环烯基团,优选为环辛烯基团,更优选为反式环辛烯基团。触发基团和激活剂经历一个快速的生物正交反应,导致掩蔽基团的释放和药物的激活。公开号:WO2014081301A1
文献信息
-
Tuning Isonitrile/Tetrazine Chemistry for Accelerated Deprotection and Formation of Stable Conjugates作者:Minghao Xu、Titas Deb、Julian Tu、Raphael M. FranziniDOI:10.1021/acs.joc.9b02522日期:2019.12.6group promote β-elimination and accelerate deprotection. Second, tetrazines with bulky substituents form stable imine conjugates even with primary isonitriles that are otherwise rapidly hydrolyzed. Third, the elimination step is independent from hydrolysis to the aldehyde and instead can occur directly from the imine intermediate. These findings will allow tuning the structures of tetrazine and isonitrile
-
Boron Trifluoride-Mediated Cycloaddition of 3-Bromotetrazine and Silyl Enol Ethers: Synthesis of 3-Bromo-pyridazines作者:Simon D. Schnell、Jorge A. González、Jan Sklyaruk、Anthony Linden、Karl GademannDOI:10.1021/acs.joc.1c01384日期:2021.9.3regiocontrol remains difficult. We achieved the Lewis acid-mediated inverse electron demand Diels–Alder reaction between 3-monosubstituted s-tetrazine and silyl enol ethers and obtained functionalized pyridazines. In the case of 1-monosubstituted silyl enol ethers, exclusive regioselectivity was observed. Downstream functionalization of the resulting 3-bromo-pyridazines was demonstrated utilizing several cross-coupling
-
Monochromophoric Design Strategy for Tetrazine-Based Colorful Bioorthogonal Probes with a Single Fluorescent Core Skeleton作者:Youngjun Lee、Wansang Cho、June Sung、Eunha Kim、Seung Bum ParkDOI:10.1021/jacs.7b10433日期:2018.1.24applicability as bioorthogonal probes was demonstrated with fluorescence bioimaging of innate microtubule and mitochondria using docetaxel-TCO and triphenylphosphonium-TCO in live cells without washing steps. We believe this study could provide new insight for the reliable and generally applicable molecular design strategy to develop bioorthogonal fluorogenic probes having an excellent turn-on ratio荧光生物正交探针是活细胞条件下荧光成像的理想选择。通过利用四嗪 (Tz) 作为生物正交反应单元和荧光猝灭剂的双重功能,荧光团-Tz 偶联物 (FLTz) 已被用于通过逆电子需求 Diels-Alder 进行荧光活细胞成像。 iEDDA) 型生物正交反应。然而,大多数 FLTz 策略依赖于供体-受体型能量转移机制,这限制了探针发射波长的红移,而不会降低荧光开启/关闭比。为了解决这个限制,本文提出了一种单色团设计策略,用于制作一系列跨越广泛发射颜色的 FLTz。对于具有最小结构差异的设计策略的系统比较,我们选择了基于吲哚嗪的发射可调谐首尔荧光 (SF) 作为模型荧光团系统。因此,通过诱导茚茚核的 Tz 和 π 共轭系统之间的强电子耦合,我们有效地淬灭了 SF-四嗪共轭物 (SFTzs) 的荧光,并在 iEDDA 与反式反应后实现了 1000 倍以上的荧光增强。环辛烯 (TCO)。重要的是,无论
-
A Cleavable C<sub>2</sub>-Symmetric <i>trans</i>-Cyclooctene Enables Fast and Complete Bioorthogonal Disassembly of Molecular Probes作者:Martin Wilkovitsch、Maximilian Haider、Barbara Sohr、Barbara Herrmann、Jenna Klubnick、Ralph Weissleder、Jonathan C. T. Carlson、Hannes MikulaDOI:10.1021/jacs.0c07922日期:2020.11.11(C2TCO) that exhibits excellent biological stability and can be rapidly and completely cleaved with functionalized alkyl-, aryl-, and H-tetrazines, irrespective of click orientation. By incorporation of C2TCO into fluorescent molecular probes, we demonstrate highly efficient extracellular and intracellular bioorthogonal disassembly via omnidirectional tetrazine-triggered cleavage.生物正交化学正在弥合静态化学连接和分子状态的动态生理调控之间的鸿沟,实现驱动多种技术的原位转化。尽管对机理的理解已经成熟,并且新的生物正交键-切割反应已经成熟,但分子 ON/OFF 控制的更广泛目标受到了现有系统无法实现快速(即几秒到几分钟,而不是几小时)和完全(即 >99%)切割的限制。为了获得高保真分子灭活所需的严格性能特征,我们设计并合成了一种新的 C2 对称反式环辛烯接头 (C2TCO),该接头表现出优异的生物稳定性,并且可以被官能化烷基、芳基和 H-四嗪快速完全裂解,而不受点击方向的影响。通过将 C2TCO 掺入荧光分子探针中,我们展示了通过全向 tetrazine 触发的切割实现高效的细胞外和细胞内生物正交分解。
-
Click‐to‐Release from <i>trans</i> ‐Cyclooctenes: Mechanistic Insights and Expansion of Scope from Established Carbamate to Remarkable Ether Cleavage作者:Ron M. Versteegen、Wolter ten Hoeve、Raffaella Rossin、Mark A. R. de Geus、Henk M. Janssen、Marc S. RobillardDOI:10.1002/anie.201800402日期:2018.8.13leaving group. In contrast to the widely used p‐aminobenzyloxy linker, which affords cleavage of aromatic but not of aliphatic ethers, the aromatic, benzylic, and aliphatic TCO ethers were cleaved as efficiently as the carbamate, carbonate, and esters. Bioorthogonal ether release was demonstrated by the rapid uncaging of TCO‐masked tyrosine in serum, followed by oxidation by tyrosinase. Finally, tyrosine
表征谱图
-
氢谱1HNMR
-
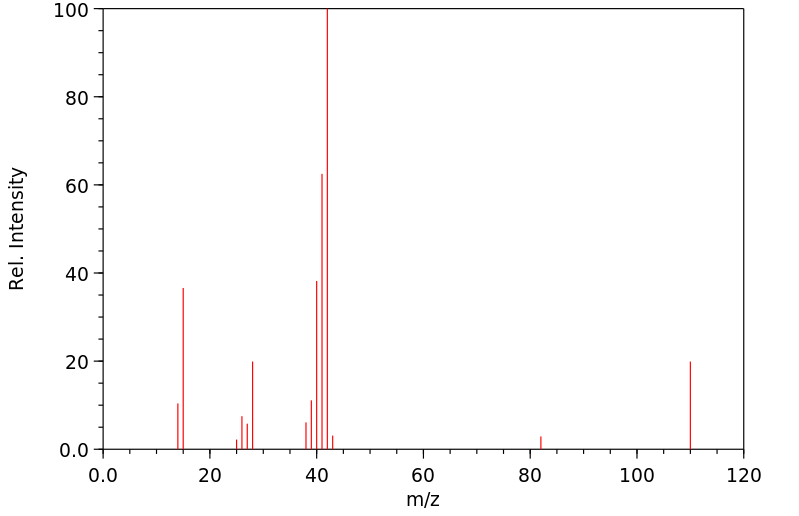
质谱MS
-
碳谱13CNMR
-
红外IR
-
拉曼Raman
-
峰位数据
-
峰位匹配
-
表征信息
同类化合物
酸四嗪
甲四嗪-氨基叔丁酯
四嗪-活性脂
四嗪-氨基叔丁酯
嘧啶并[4,5-e]-1,2,3,4-四嗪
二甲基-1,2,4,5-四嗪
二氯均四嗪
METHYLTETRAZINE-ACID,甲基四嗪-羧基
6-苯基-1,2,4,5-四嗪-3-胺
6-乙基-1,2,4,5-四嗪-3-胺
6-丁基氨基-3-(3,5-二甲基吡唑-1-基)四嗪
6-(3,5-二甲基吡唑-1-基)-1,2,4,5-四嗪-3-胺
3-苯基-6-(吡啶-2-基)-1,2,4,5-四嗪
3,6-二苯基-1,2,4,5-四嗪
3,6-二溴-1,2,4,5-四嗪
3,6-二氨基-1,2-二氢-1,2,4,5-四嗪盐酸盐
3,6-二-4-吡啶基-1,2,4,5-四嗪
3,6-二-2-吡啶基-1,2,4,5-四嗪
3,6-二(噻吩-2-基)-1,2,4,5-四嗪
3,6-二(3-吡啶基)-1,2,4,5-四氮杂苯
3,6-二(3,5-二甲基-1H-吡唑-1-基)-1,2,4,5-四嗪
1-[6-(3,5-二甲基吡唑-1-基)-1,2,4,5-四嗪-3-基]-2-(丙-2-亚基)肼
1,2-二氢-1,2,4,5-四嗪-3,6-二酮
1,2,5-噁二唑-3-胺,4-[(5-甲基-2H-四唑-2-基)甲基]-
1,2,4,5]四嗪-3,6-二羧酸
1,2,4,5-四嗪-3-胺
1,2,4,5-四嗪-3,6-二羧酸二甲酯
1,2,4,5-四嗪,3-甲氧基-6-苯基-
1,2,4,5-四嗪
(9CI)-吡咯并[2,1-d]-1,2,3,5-四嗪
(6-肼基-1,2,4,5-四嗪-3-基)肼
3,6-Dicyclopropyl-s-tetrazin
3-Methyl-4-methylaminotriazol-1-oxid
1,2,4,5-Tetrazin-3-amine, 6-cyclohexyl-
7-amino-2-trifluoromethyl-6-(5-trifluoromethyl-1,3,4-thiadiazol-2-yl)-4,4a,5,6-tetra-hydroimidazo[1,5-d][1,3,4]thiadiazin-6-ium pentaiodide
3,6-bis(ethylamino)-1,2,4,5-tetrazine
Gtersunqcxeonk-uhfffaoysa-
aminotetrazine argon
3-amino-s-tetrazine*Ar2
N-(2-chloro-1-methoxyethyl)-6-(3,5-dimethyl-1H-pyrazol-1-yl)-1,2,4,5-tetrazin-3-amine
3,6-di(2-cyclopentylidenehydrazino)-1,2,4,5-tetrazine
4,4'-(butane-2,3-diylidenebis(azaneylylidene))bis(4H-1,2,4-triazole-3-thiol)
6-Isopropyl-s-triazolo<4,3-b>-s-tetrazin-3-thiol
3-amino-6-(3,5-diamino-1,2,4-triazol-1-yl)-1,2,4,5-tetrazine
3,6-bis(4-bromo-3,5-dimethylpyrazol-1-yl)-1,2,4,5-tetrazine
1,4-s-Tetrazin-15N2
N-(sec-butyl)-6-(3,5-dimethyl-1H-pyrazol-1-yl)-1,2,4,5-tetrazin-3-amine
1,2-Di-4-pyridazinylethanone oxime
trans-Pt(S[CN4(C2H5)])2(PMe3)2