四氟化硅 | 7783-61-1
分子结构分类
-
物化性质
-
计算性质
-
ADMET
-
安全信息
-
SDS
-
制备方法与用途
-
上下游信息
-
文献信息
-
表征谱图
-
同类化合物
-
相关功能分类
-
相关结构分类
物化性质
-
熔点:-90°C
-
沸点:-86 °C
-
密度:1.66
-
溶解度:与H2O反应
-
物理描述:Silicon tetrafluoride appears as a colorless, nonflammable, corrosive and toxic gas with a pungent odor similar to that of hydrochloric acid. Very toxic by inhalation. Vapor is heavier than air. Under prolonged exposure to heat the containers may rupture violently and rocket.
-
颜色/状态:COLORLESS GAS
-
气味:VERY PUNGENT ODOR SIMILAR TO THAT OF HYDROGEN CHLORIDE
-
蒸汽密度:3.57 (gas, air = 1) @ 15 °C
-
稳定性/保质期:
-
腐蚀性:Pure anhydrous gaseous silicon tetrafluoride is only very slightly corrosive
计算性质
-
辛醇/水分配系数(LogP):1.3
-
重原子数:5
-
可旋转键数:0
-
环数:0.0
-
sp3杂化的碳原子比例:0.0
-
拓扑面积:0
-
氢给体数:0
-
氢受体数:4
ADMET
安全信息
-
TSCA:Yes
-
危险等级:2.3
-
危险品标志:T+,T,C
-
安全说明:S23,S24/25,S26,S36/37/39,S45,S7/9
-
危险类别码:R26
-
WGK Germany:3
-
危险品运输编号:1859
-
RTECS号:VW2327000
-
包装等级:O52
-
危险类别:2.3
-
危险标志:GHS05,GHS06
-
危险性描述:H300 + H310 + H330,H314
-
危险性防范说明:P260,P264,P280,P284,P301 + P310,P302 + P350
-
储存条件:储存注意事项:应将物品存放在阴凉、通风的有毒气体专用库房中,并远离火种和热源。库温不宜超过30℃。与酸类及食用化学品分开存放,严禁混储。储存区域需配备泄漏应急处理设备。
制备方法与用途
四氟化硅亦称“四氟甲硅烷”。1771年由瑞典著名化学家舍勒发现,化学式为SiF4,分子量104.08。它是一种无色气体,具有窒息性气味且有毒。其熔点为-90.2℃、沸点为-86℃(在-95.2℃升华),临界温度为-14.15℃,临界压力为3.715MPa,相对密度为4.69。它溶于无水乙醇、氢氟酸和硝酸,而不溶于乙醚。
四氟化硅在潮湿空气中会水解生成氟化氢和硅酸,并形成浓烟。遇水会生成原硅酸H4SiO4和氢氟酸,而水解产生的氢氟酸与未水解的四氟化硅络合生成氟硅酸。纯氟硅酸不易存在,因易分解,只能制得其60%的水溶液。氟硅酸是一种强酸。
四氟化硅几乎不与其他非金属(如碳、磷、碘)或某些金属(如锌、汞、硫化氢、熔融氯化钾、无水碱金属碳酸盐和硼酸盐)反应,能制止镁在空气中氧化,并在灼热条件下与钾、钠反应生成硅及其氟化物和氟硅酸盐。它还能与氯化铝在高温下反应生成四氯化硅。
制法可由浓硫酸与二氧化硅和氟化钙反应或通过分解含氟磷矿石获得四氟化硅。欲得极纯的四氟化硅,可通过热分解氟硅酸盐得到:BaSiF6=BaF2+SiF4。
用途四氟化硅主要用于制备有机硅化合物、氟硅酸和氟化铝,并在化学分析、油井钻探、催化剂以及熏蒸剂中也有应用。
分子结构与性质四氟化硅的分子式为SiF4,其分子结构由sp3杂化的硅原子形成正四面体。在潮湿空气中会产生腐蚀性且刺激性的氟化氢烟雾,并遇水剧烈反应生成极强的腐蚀性氟硅酸。它主要应用于氮化硅(Si3N4)和硅化钽(TaSi2)等材料的蚀刻、发光二极管P型掺杂、离子注入工艺、外延沉积扩散中的硅源以及光导纤维中高纯石英玻璃原料。
危险特性四氟化硅不易燃,但容易水解成氟硅酸,并在潮湿空气中形成氟化氢。它具有窒息性、刺激性和腐蚀性,对眼睛、皮肤和呼吸系统有严重损害,可导致长期痛苦甚至残疾;吸入会导致呼吸困难,肺水肿及化学性肺炎,还会引起牙齿脱钙,引发骨硬化症。大鼠吸入LC50值为300ppm。受热后瓶内压力增加,存在爆炸危险。
贮运须知应将四氟化硅装于特殊钢瓶中,并储存于阴凉、通风的仓库内,远离热源和火源,避免潮湿和雨淋。需标贴“毒气、腐蚀品”标志,轻装轻卸。灭火剂可选用雾状水或砂土。
性质与应用四氟化硅用于制备氟硅酸及氟化铅,并用作水泥和人造大理石的硬化剂以及纯硅制造的中间体。
安全标准四氟化硅属于有害气体,高毒性。急性毒性吸入-大鼠LC50:2272ppm。遇热或日光钢瓶可爆;泄漏时会释放剧毒烟雾。燃烧会产生有毒氟化物烟雾。储存仓库应保持通风低温干燥。搬运需轻拿轻放。灭火剂为雾状水和砂土。职业暴露限值为TWA 2.5毫克/立方米。
上下游信息
反应信息
-
作为反应物:描述:参考文献:名称:SANCIER, KENNETH M.摘要:DOI:
-
作为产物:参考文献:名称:WEISS. , ROLAND;HUTTNER, WOLF;BRENNFLECK, KARL;SCHEIFFARTH, JAKOB摘要:DOI:
文献信息
-
Manufacture of difluoroethylene carbonate, trifluoroethylene carbonate and tetrafluoroethylene carbonate申请人:Olschimke Jens公开号:US20120253058A1公开(公告)日:2012-10-04Difluoroethylene carbonate, trifluoroethylene and tetrafluoroethylene carbonate are produced by the reaction between elemental fluorine and ethylene carbonate or fluorinated ethylene carbonates with a lower degree of fluorination.
-
Composition of a Fluorinated Organic Carbonate and a Lewis Acid申请人:Olschimke Jens公开号:US20120177987A1公开(公告)日:2012-07-12A method for handling fluorinated organic carbonates such that degradation reactions are minimized or even completely suppressed and hence initial purity of fluorinated organic carbonates is essentially maintained during handling. Compositions comprising a fluorinated organic carbonate with improved stability against degradation reactions. The compositions comprise equal to or less than 500 ppm of a Lewis acid.
-
WIBERG N.; VASISHT S. K.; BAYER H.; MEYERS R., CHEM. BER., 1979, 112, NO 7, 2718-2729作者:WIBERG N.、 VASISHT S. K.、 BAYER H.、 MEYERS R.DOI:——日期:——
-
SYVERSON, DANIEL J.;DURANKO, GARY T., SOLID STATE TECHNOL., 31,(1988) N0, C. 101-104作者:SYVERSON, DANIEL J.、DURANKO, GARY T.DOI:——日期:——
-
KINDIG, JAMES K.作者:KINDIG, JAMES K.DOI:——日期:——
表征谱图
-
氢谱1HNMR
-
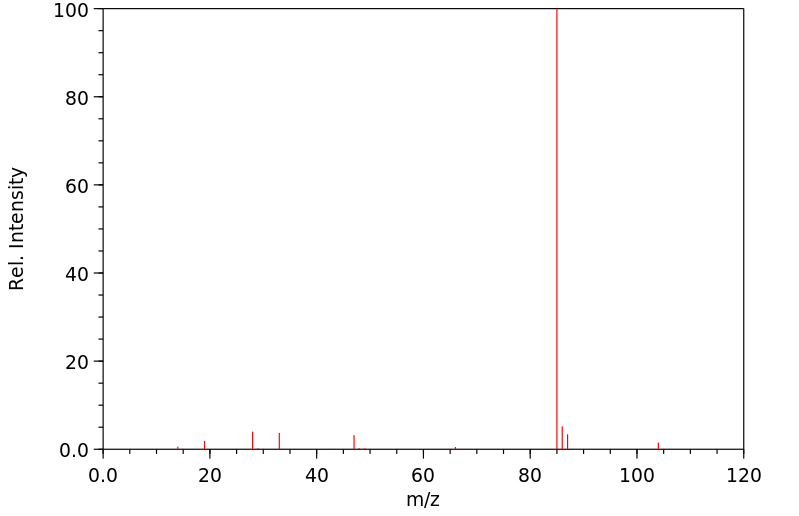
质谱MS
-
碳谱13CNMR
-
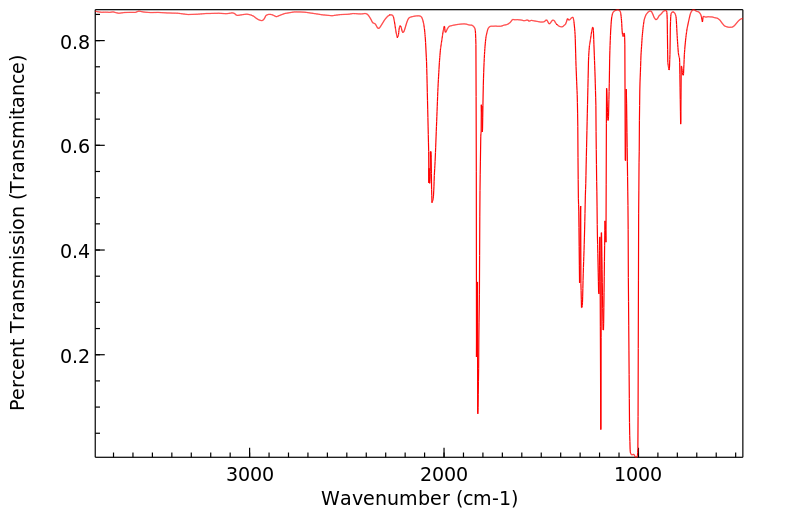
红外IR
-
拉曼Raman
-
峰位数据
-
峰位匹配
-
表征信息